Version 1
Intro
I- Structure des différents organométalliques
1/ Les organomagnésiens
2/ Les lithiés et cuprates lithiés
3/Autres : zinciques et cadmiens
II- Réactivité Acido basique et conséquences
1/ Actions des acides
2/ Mode de synthèse et mise en oeuvre expérimentale
III-Réactivité nucléophile
1/ Listing des additions des organomagnésiens
2/ Utilisation spécifique des lithiés et cuprates lithiés
3/ Intérêt des cadmiens
Conclusion
En version
plus
développée...
Intro :
Définition : un organométallique est un composé présentant au moins une liaison C-Métal
I- Structure des différents organométalliques
1/ Les organomagnésiens
On présente les caractéristiques essentielles :
- Polarisation de la liaison de telle sorte que Cδ- -- Mg δ+ , Mg formellement 2+
- Deux lacunes sur Mg => nécessité d'un donneur de doublet pour le stabiliser : solvant éther ou THF ( + actif )
Montrer la structure du cuprate lithié (R)2 Cu Li avec Cu formellement 1+ , citer l'existence de (RCu)n sans réactivité.
Noter que la liaison R Li est beaucoup plus IONIQUE que covalente
3/Autres : zinciques , cadmiens , mercuriques...
R2-Zn et R2-Cd et R2-Hg et (C2H5)4Pb sont d'autres exemples d'organométalliques
- R2-Cd est moins réactif que les organomagnésiens et par exemple sera plus régiosélectif que RMgX
- Le plomb tétra éthyl fut célèbre comme antidétonnant dans l'essence 98 ...sans plomb veut dire sans (C2H5)4Pb (essence mieux raffinée et moteurs réglés différemment )
- Les organomercuriques sont très peu réactifs ( δ+ et δ- trop faibles ) . Les organozinciques peu employés
II- Réactivité Acido basique et conséquences
1/ Actions des acides
La polarité négative des C rend les organométalliques BASIQUES . pKa = 40 environ pour un RMgX / RH , Mg2+ , Cl-
- réaction avec H2O : bilan => milieux anhydres nécessaires
- Réaction avec un alcool : bilan , généraliser ( amines , acides carboxyliques )
- Cas particulier de l'action sur un R-C=C-H => synthèse de R-C=C-Mg-X
RMgX : R-X + Mg --> R-Mg-X
Présenter ici le schéma en énonçant le protocole complet de synthèse des organomagnésiens :
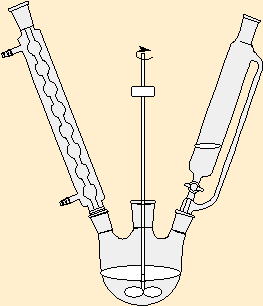 |
|
R2CuLi : à partir des organilithiés : voir cours ( la seule qui soit au programme ) , milieu anhydre
III- Réactivité nucléophile
1/ Listing des additions des organomagnésiens
Additions nucléophiles : réagit sur toute molécule possédant une insaturation polarisée : aldéhydes, cétones, nitriles, esters, chlorures d'acyle , anhydrides d'acide , dioxyde de carbone, époxydes.
- Mode de synthèse privilégié d'alcools à plus longues chaînes : mécanisme sur un époxyde développé
- Instabilité de certains intermédiaires :
- action sur un chlorure d'acide développé ( Rappel : s'additionne 2 x , on finit par l'addition sur une cétone )
- action sur un nitrile : décomposition de l'imine en milieu acide => obtention cétone
- Analogie esters, chlorures d'acyle , anhydrides d'acide
- Résultat de l'action sur CO2
Cas particulier des α - énones :
- Addition 1,4 des cuprates lithiés , sous contrôle orbitalaire, par action nucléophile de C sur l'atome de + gros coeff de la BV de l'α - énone . Mécanisme, avec tautomérie céto énolique en fin .
- Addition 1,2 des lithiés, sous contrôle de charge , car liaison R-Li quasi ionique , sur le C de plus grande charge positive de l'α - énone . Mécanisme superflu.
- Mélange obtenu en général avec un RMgX .
Moins réactifs que les magnésiens, ils ne réagissent pas sur les esters : prendre l'exemple d'une molécule possédant ester et aldéhyde et donner le produit final à l'aide d'un cadmien (action seulement sur l'aldéhyde ) , alors qu'avec un RMgX , addition triple (1 fois sur l'aldéhyde, 2 fois sur l'ester )
Remarque bis : On est hors programme ici...donc on raconte : j'ai vu dans un problème une fois que ...
Conclusion:
Les organométalliques sont un moyen efficace de synthèse pour allonger la chaîne carbonée , cad créer des liaisons C-C . Mais il existe aussi l'aldolisation, la synthèse malonique, Diels Alder...et les polyadditions radicalaires ou anioniques -> polymères.
Les
Organométalliques
Version 2
Intro
I- Méthodes d'obtention
1/ Les organomagnésiens
2/ Les cuprates lithiés
II- Structure et réactivité
1/ Tétravalence du magnésium
2/ Caractéristique commune : Polarisation des C liés
3/ Réactivité A/B et nucléophilie
III-Les réactions d'addition nucléophile
1/ Listing des additions des organomagnésiens
2/ Utilisation spécifique des lithiés et cuprates lithiés
3/ Intérêt des cadmiens
Conclusion
En version
plus
développée...
Intro :
Définition : un organométallique est un composé présentant au moins une liaison C-Métal
Exemples : RMgX , (R)2 Cu Li , ou RLi mais aussi : R2-Zn et R2-Cd et R2-Hg et (C2H5)4Pb
Le plomb tétra éthyl fut célèbre comme antidétonnant dans l'essence 98 ...sans plomb veut dire sans (C2H5)4Pb (essence mieux raffinée et moteurs réglés différemment )
Remarque : Les organocadmiens ou zinciques apparaissent parfois dans certains problèmes avec mention de leurs particularités réactionnelles...mais ces quatre derniers organométalliques sont TRES limite programme !
I- Méthodes d'obtention
1/ Les organomagnésiens
R-X + Mg --> R-Mg-X
Présenter ici le schéma en énonçant le protocole complet de synthèse des organomagnésiens :
 |
|
2/ Les cuprates lithiés
à partir des organilithiés : voir cours ( la seule qui soit au programme ) , milieu anhydre
II- Structure et réactivité
1/ Tétravalence du magnésium
Deux lacunes sur Mg => nécessité d'un donneur de doublet pour le stabiliser : solvant éther ou THF ( + actif )
- Schéma classique avec EtOEt
- Particularité du THF : doublets plus disponibles => plus adapté aux dérivés halogénés difficiles : exemple CH2=CH-Cl ( chlorure de vinyle )
Polarisation de la liaison de telle sorte que Cδ- -- Métal δ+ : c'est là l'intérêt ...
- dans RMgX , Mg formellement 2+
- Montrer la structure du cuprate lithié (R)2 Cu Li avec Cu formellement 1+ , citer l'existence de (RCu)n sans réactivité.
- Noter que la liaison R Li est beaucoup plus IONIQUE que covalente
- R2-Cd est moins réactif que les organomagnésiens et par exemple sera plus régiosélectif que RMgX
- Les organomercuriques sont très peu réactifs ( δ+ et δ- trop faibles ) . Les organozinciques peu employés
La polarité négative des C rend les organométalliques BASIQUES . pKa = 40 environ pour un RMgX / RH , Mg2+ , Cl-
- réaction avec H2O : bilan => milieux anhydres nécessaires
- Réaction avec un alcool : bilan , généraliser ( amines , acides carboxyliques )
- Cas particulier de l'action sur un R-C=C-H => synthèse de R-C=C-Mg-X
III- Les réactions d'addition nucléophile
1/ Listing des additions des organomagnésiens
Additions nucléophiles : réagit sur toute molécule possédant une insaturation polarisée : aldéhydes, cétones, nitriles, esters, chlorures d'acyle , anhydrides d'acide , dioxyde de carbone, époxydes.
- Mode de synthèse privilégié d'alcools à plus longues chaînes : mécanisme sur un époxyde développé
- Instabilité de certains intermédiaires :
- action sur un chlorure d'acide développé ( Rappel : s'additionne 2 x , on finit par l'addition sur une cétone )
- action sur un nitrile : décomposition de l'imine en milieu acide => obtention cétone
- Analogie esters, chlorures d'acyle , anhydrides d'acide
- Résultat de l'action sur CO2
Cas particulier des α - énones :
- Addition 1,4 des cuprates lithiés , sous contrôle orbitalaire, par action nucléophile de C sur l'atome de + gros coeff de la BV de l'α - énone . Mécanisme, avec tautomérie céto énolique en fin .
- Addition 1,2 des lithiés, sous contrôle de charge , car liaison R-Li quasi ionique , sur le C de plus grande charge positive de l'α - énone . Mécanisme superflu.
- Mélange obtenu en général avec un RMgX .
Moins réactifs que les magnésiens, ils ne réagissent pas sur les esters : prendre l'exemple d'une molécule possédant ester et aldéhyde et donner le produit final à l'aide d'un cadmien (action seulement sur l'aldéhyde ) , alors qu'avec un RMgX , addition triple (1 fois sur l'aldéhyde, 2 fois sur l'ester )
Remarque bis : On est hors programme ici...donc on raconte : j'ai vu dans un problème une fois que ...
Conclusion:
Les organométalliques sont un moyen efficace de synthèse pour allonger la chaîne carbonée , cad créer des liaisons C-C . Mais il existe aussi l'aldolisation, la synthèse malonique, Diels Alder...et les polyadditions radicalaires ou anioniques -> polymères.