Si vous souhaitez trouver les règles de nomenclature organique relatives aux espèces organiques rencontrées dans le cours de première et deuxième année , c'est le premier § ci-dessous, découpé par type de fonctions, accessibles diretement par les liens ci-contre (tableau à gauche)
Pour trouver les espèces dont le nom est un "monument historique", hors nomenclature, est à connaître par coeur, alors que vous l'avez oublié, cliquez ici .
Si enfin vous souhaitez acquérir quelques notions de nomenclature relative aux espèces minérales les plus courantes et apprendre leurs noms (le minimum vital) , c'est là qu'il faut cliquer.
Nomenclature en chimie organique
Alcanes et dérivés halogénés
Les alcanes ont pour formule brute CnH2n+2 .On les appelle parfois des composés aliphatiques Le groupe correspondant porte le suffixe yle et est nommé alkyle:
Alcane : CnH2n+2 groupe correspondant : Alkyle : CnH2n+1 -
méthane CH4 Méthyl : CH3-
éthane C2H6 éthyl : C2H5-
propane C3H8 propyl : C3H7-
butane C4H10 butyl ; C4H9-
pentane C5H12 pentyl : C5H11-
hexane hexyl
heptane. heptyl
octane C8H18 octyl : C8H17-
nonane nonyl
décane C10H22 décyl : C10H21-
undécane C11H24 undécyl : C11H23-
dodécane C12H26 dodécyl : C12H25-
Pour les alcanes ramifiés :
On appelle chaîne principale la chaîne la plus longue. On la numérote de telle sorte que la première ramification soit portée par le carbone de plus petit numéro.
On numérote alors la ramification à partir de l'atome rattaché à la chaîne principale.
Si la chaîne latérale est elle même ramifiée (ou avec d'autres fonctions) , son nom est mis entre parenthèses :
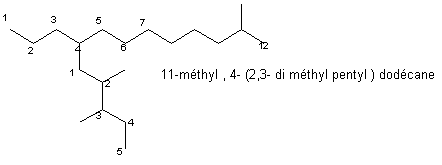
Pour les alcanes cycliques , le nombre d'atomes de carbones du cycle donne le nom cycloalcane , sur lequel sont alors fixés les autres groupes alkyl .
Si le cycle ne porte qu'un autres groupe alkyl, alors le nom est alkyl- cycloalcane
Si le cycle est porteurs de plusieurs autres groupes, il est numéroté à partir du groupe le plus important, les autres groupes étant alors précédés de leur n° de position:

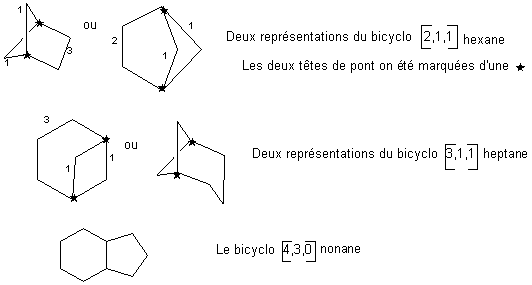
Pour les alcanes bicycliques , le préfixe devient bicyclo devant le mot alcane correspondant au nombre d'atomes de C de l'ensemble des 2 cycles : bicycloalcane.
L'agencement des cycles est calculé à partir de l'identification des têtes de pont, c'est à dire des carbones communs aux deux cycles.
Sont ensuite donnés entres crochets le nombres de C "traversés" pour passer d'une tête de pont à l'autres par tous les chemins possibles :
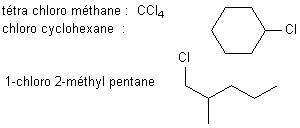
Les dérivés halogénés ou halogéno alcanes sont des alcanes dont un ou plusieurs H ont été remplacés par les halogènes. Leur nomenclature est calquée sur celle des alcanes ramifiés : on indique la position de l'halogène par sa position sur la chaîne, devant le terme halogéno:
Ces composés sont des composés insaturés c'est à dire qu'ils ne portent pas le nombre maximum d'hydrogène possible par atone de carbone.
Les alcènes (au moins une double liaison C=C) ont un nom constitué du radical alcane dont ils dérivent et du suffixe ène.
alcane devient alcène
éthane éthène (nom historique à connaître : éthylène) CH2=CH2
propane propène CH2=CH-CH3
Pour les chaînes plus longues, il faut indiquer la position de la double liaison . On numérote la chaîne de telle façon que le premier C rencontré doublement lié ait le n° le plus petit possible. La position est alors indiquée par le n° placé avant le suffixe -ène , du premier carbone rencontré lors de la traversée de la double liaison:

Les alcynes possèdent au moins une triple liaison C=C , ont un nom constitué du radical alcane dont ils dérivent et du suffixe yne :
alcane devient alcyne
éthane éthyne (nom historique à connaître : acéthylène) CH=CH
propane propène CH=C-CH3
Les alcynes terminaux du type CH=C-R sont parfois appelés acétyléniques vrais.
Pour les chaînes plus longues, il faut indiquer la position de la triple liaison . On numérote la chaîne de telle façon que le premier C rencontré triplement lié ait le n° le plus petit possible. La position est alors indiquée par le n° placé avant le suffixe -yne , du premier carbone rencontré lors de la traversée de la triple liaison:
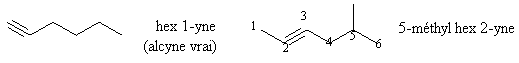
Les éthers ou étheroxydes
On rencontre différentes façons de nommer les étheroxydes, de formule générale R-O-R'...
Officiellement...et quasi jamais employé !!! : on compte les atomes constitutifs de la chaîne , y compris l'oxygène ce qui donnera le radical alcane correspondant. On numérote la chaîne de telle sorte que l'atome d'oxygène porte le plus petit n° possible, et on ajoute alors le préfixe i-oxa ( a , pas d'erreur de frappe...) ce qui donne la première ligne ci dessous.
Usuellement, on ajoute le suffixe oxy à la chaîne le plus petit cur l'oxygène, citée comme un groupe fixé sur le carbone i de la plus longue chaîne ce qui donne la deuxième ligne ci dessous.
Autre méthode usuelle : on cite les deux groupes portés par l'oxygène par leur nom alkyl et on termine par oxyde qui représente -O- , sur la troisième ligne...
La deuxième et troisième options sont les plus courantes.
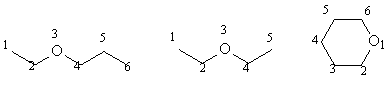
Usuellement 1-éthoxy propane 1-éthoxy éthane
ou encore éthyl propyl oxyde diéthyl oxyde cyclopentyl oxyde
Les cations
Le suffixe IUM est caractéristique des cations:

L'ion H+ est l'ion hydronium.
Les anions
Les anions en chimie organiuque sont obtenus en enlevant un proton d'une espèce acide : la nomenclature utilise le radical de l'espèce acide dont il est issu, et y met un suffixe caractéristique...qui dépend de l'acide de départ...
Les acides carboxyliques : remplacer ique par ate donc alcanoate
Les alcools : remplacer ol par olate donc alcoolate
Les alcanes : ajouter ure ou ate au radical alkyl associé donc alkylate ou alkylure
H- : hydrure de l'espèce associée.
Les amines donnent des amiDures ( attention : rien à voir avec les amides qui ne sont pas acides !)
Donc : Acide butanoïque (R-COOH) donne l'ion butanoate (R-COO-)
Le butanol (R-OH) donne l'ion butanolate ( RO-)
Le butane (R) donne de butylure (R-) ou le butylate
La butylamine (R-NH2) donne le butylamidure (R-NH-)
La diisopropylamine ( (CH3)2CH)2-NH) donne le disiopropylamidure (CH3)2CH)2-N- )
Les dérivés du benzène
Soit le groupe benzène est pris comme racine et le nom du produit se termine par benzène, les groupes étant alors signalés par leur position.
Les positions des groupes présents sur un benzène peuvent être signalées soit par une numérotation, soit par les positions ortho, méta , para.
Soit le benzène est lui même regardé comme un groupe fixé sur une chaîne autre et on le nomme alors par PHENYL .
Certains groupes changent totalement le nom du radical benzène.
-OH fixé sur le
benzène
donne un PHENOL
-NH2 fixé sur le benzène donne de l'ANILINE
-CH3 fixé sur le benzène devrait porter le nom de méthyl benzène mais se nomme TOLUENE . Le groupe associé se nomme de groupe BENZYL
L'acide benzoïque et le benzaldéhyde portent leur fonction sur un carbone en plus du cycle benzénique:
-NH2 fixé sur le benzène donne de l'ANILINE
-CH3 fixé sur le benzène devrait porter le nom de méthyl benzène mais se nomme TOLUENE . Le groupe associé se nomme de groupe BENZYL
L'acide benzoïque et le benzaldéhyde portent leur fonction sur un carbone en plus du cycle benzénique:
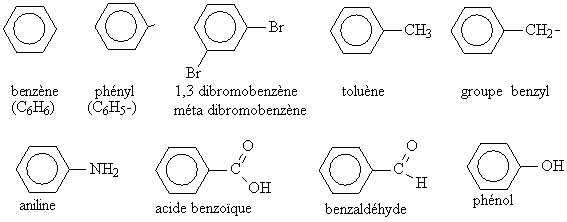
Les acides organiques
Les acides organiques étudiés ici sont les acides CARBOXYLIQUES et acides SULFONIQUES.
Les acides sulfoniques sont de la forme R-SO3H . Leur base associée est R-SO3-.
Leur nom est une juxtaposition : acide alcane sulfonique :
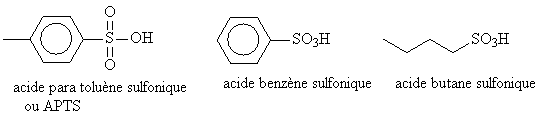
Les acides carboxyliques sont les acides les plus courants.
On compte la chaîne la plus longue contenant le groupe COOH, y compris le carbone de la fonction carboxylique ce qui nous donne le radical alcane associé.
On ajoute alors le suffixe oïque et le mot acide devant : acide alcanoïque.
Le carbone de la fonction acide est toujours le n° 1 en cas de numérotation nécessaire.
Pour les cycloalcanes, on ne compte que les carbones du cycle pour déterminer la racine alcane et on ajoute le mot carboxylique au lieu du suffixe oïque : acide cycloalcane carboxylique
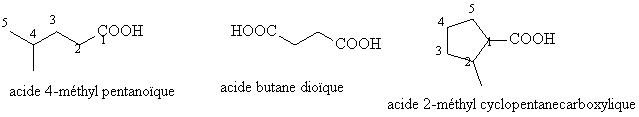
ou acide succinique
L'acide éthanoïque CH3-COOH porte aussi le nom d'acide acétique.
L'acide benzoïque devrait donc s'appeler l'acide benzène carboxylique.
Les anhydrides
On distingue la nomenclature des anhydrides symétriques , issus de la déshdratation intermoléculaire de deux acides identiques, ou de la déshydratation intramoléculaire d'un diacide c'est à dire un anhydride cyclique, de la nomenclature des anhydrides non symétriques, obtenus à partir de deux acides différents par déshydratation intermoléculaire.
Pour les anhydrides symétriques ou cycliques
De la base acide alcanoïque, on remplace acide par anhydride, et on rajoute si l'anhydride n'est pas cyclique le préfixe bis: acide alcanoïque donne anhydride bis alcanoïque
Si Cyclique: acide alcanedioïque donne anhydride alcanedioïque
Si l'acide porte un nom non officiel, on conserve ce nom dans l'anhydride :
L'acide succinique (acide butanedioïque) donne l'anhydride succinique par exemple.
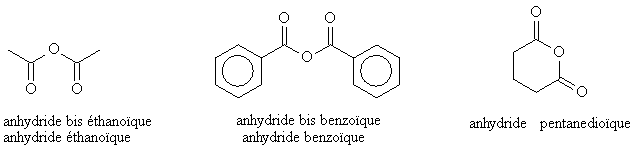
Le préfixe bis est souvent ommis...
Pour les anhydrides non symétriques
On rappelle les deux acides différents dans la nomenclature:
acide alcanoïque + alcanoïque' donne anhydride alcanoïque alcanoïque'

Remarque : ces anhydrides sont en général sans intérêt puisqu'ils induisent des mélages lors de leur utilisation et donc très peu courants...
Les esters
La nomenclature des esters dérive des acides dont ils dérivent, via le nom de leur base conjuguée. Le groupe fixé sur l'oxygène est nommé par alkyl.
Acide alcanoïque donne alcanoate d'alkyl
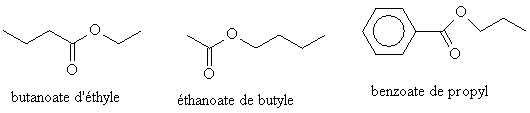
Les chlorures d'acyle
On définit les groupes alcanoyle ou acyle comme étant :

Pour trouver la racine alcane on compte la chaîne la plus longue , le carbone doublement lié avec l'oxygène compris . Ce groupe se nomme alcanoyle . Le nom est alors chlorure d'alcanoyle
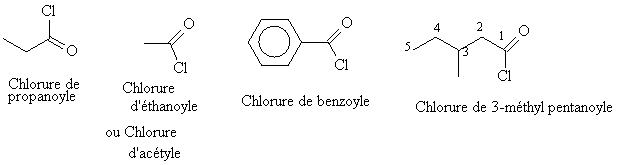
On remarquera le suffixe ure associé au chlore . Un chlorure d'acyle est donc regardé comme l'association d'un ion chlorure Cl- et d'un ion acylium chargé + .
Les aldéhydes et cétones
Les aldéhydes
De formule R-COH, ils possèdent donc sur un carbone terminal le groupe la fonction carbonyle et un hydrogène.
Leur nom est constitué du radical alcane et du suffixe al pour donner alcanal
Le carbone portant =O est compté dans le décompte de la chaîne la plus longue fournissant le radical alcane, et est numéroté 1 si nécessaire.
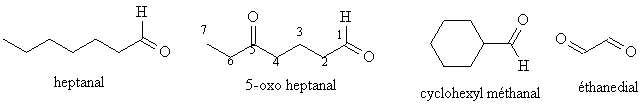
Le groupe =O est nommé oxo s'il est présent en plus dans la chaîne, c'est à dire si le produit porte en plus une fonction cétone.
On emploie le pré suffixe di dans le cas de deux fonctions aldéhydes dans le même produit.
On en déduit que la nomenclature de l'aldéhyde prédomine sur celle de la cétone.
Les cétones
Le groupe =O en position non terminale sur un carbone par ailleurs lié à deux groupes alkyle est une cétone.
On compose le nom d'une cétone à partir du radical alcane associé et du suffixe one . L'emplacement du groupe est signalé par le numéro du carbone porteur, le plus petit possible (ce qui donne l'ordre de numérotation de la chaîne)
soit alcanone ou alcane i one ou i,i alcanedione
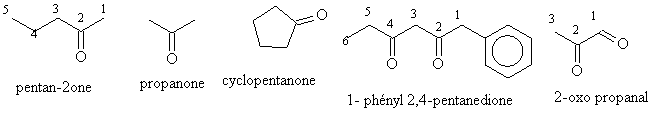
Le groupe cétone s'efface donc devant le groupe aldéhyde. Il est alors désigné avec sa position par le préfixe oxo.
Les alcools
Si la fonction alcool est prépondérante, le nom est composé du radical alcane associé et du suffixe ol. L'emplacement du groupe est signalé par le n° du carbone porteur ce qui donne un alcanol ou un alcan-i ol
Si la fonction alcool n'est pas préondérante, la chaîne principale porte alors un groupe -OH nommé hydroxy précisé dans sa position par un n° qui le précède:
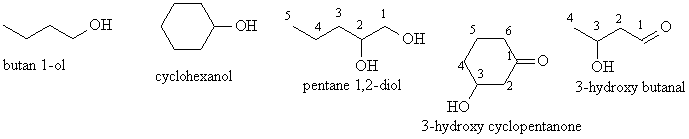
Les amines
Si R est aromatique, l'amine est dite aromatique. Elle est dite aliphatique dans le cas contraire.
La formule brute d'une amine saturée ne dépend pas de sa classe : CnH2n+2+xNx
Les amines peuvent être primaire, secondaires ou tertiaires, c'est-à-dire portant 1 , 2, ou 3 groupes alkyl.
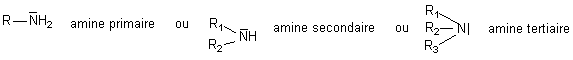
Les noms des amines précisent leur classe . Il existe trois façons officielles de les nommer :
Amines primaires Amines secondaires Amines tertiaires
alkyl amine alkyl, alkyl amine alkyl, alkyl, alkylamine
i-amino alcane N alkyl i-amino alcane N alkyl, N alkyl i-aminoalcane
alcanamine N alkyl alcanamine Nalkyl, Nalkyl, alcanamine
Le groupe alcane de la deuxème voie de nomenclature est le groupe le plus long.
Ainsi :
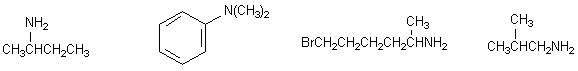
2-butylamine isobutylamine
2-amino butane 5-bromo2-amino hexane 1-amino 2-méthyl propane
butan 2-amine N,N diméthyl aniline 2-méthyl propan1-amine
Les noms usuels hors nomenclature
Un certain nombre d'espèces connues depuis fort longtemps portent un noms, qui bien que hors nomenclature est LE nom employé. Il est donc INDISPENSABLE de les connaître. En voici une liste non exhaustive...
éthylène = éthène : CH2=CH2
acétylène = éthyne : CH=CH
acide acétique = acide éthanoïque : CH3COOH
acétate = éthanoate : CH3COO-
acétate d'alkyl = éthanoate d'alkyl : CH3COOR
groupe acétyl = groupe éthanoyle : CH3-(C=O)-
acétone = propanone : CH3-(C=O)-CH3
toluène = méthyl benzène :
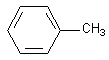
aniline = amino benzène :
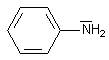
pyridine :
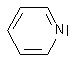 (base douce , non
nucléphile)
(base douce , non
nucléphile)éther = diéthyl oxyde :

naphtalène :
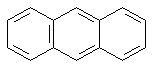
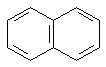 anthracène
:
anthracène
: 
Quelques espèces sont dénommées par des groupes de lettres :
DMSO = diméthylsulfoxyde :
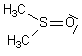 ( solvant polaire aprotique )
( solvant polaire aprotique )THF = tétrahydrofurane :
 ( solvant polaire
aprotique )
( solvant polaire
aprotique )LDA = Di isopropyl Amidure de Lithium :
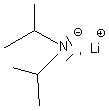 nBuLi
= n-butyl lithium
:
nBuLi
= n-butyl lithium
: 
ces deux dernières étant des bases très fortes
Nomenclature minérale ( très minimale !) d'après Cours de chimie minérale de Maurice Bernard (Annexe 1)
Quelques noms de cations :
Le nom du cation est le nom de l'élément ,pour les cations monoatomiques...eventuellement suivi de leur nombre d'oxydation s'il y a doute. Si deux nombres d'oxydation existent , il arrive que l'on transforme le nom de l'atome en adjectif via le suffixe eux pour le plus petit des deux nombres d'oxydation et le suffixe ique pour le plus grand des deux nombres d'oxydation...
Na+ : sodium K+ : potassium Li+ : Lithium
Fer2+ : fer II ( de fer II ou ferreux ) Fer3+ : fer III ( de fer III ou ferrique )
Cu+ : Cu I ( de cuivre I ou cuivreux ) Cu2+ : Cu II ( de cuivre II ou cuivrique )
Hg22+ : Hg I ( de mercure I ou mercureux ) Hg2+ : Hg II ( de mercure II ou mercurique)
NH4+ :ammonium H3O+ oxonium ( parfois hydronium)
Globalement, on recontre pour les cations les suffixes eux, ique ou ium
Quelques noms d'anions
Cl- : chlorure Br- : bromure H- : hydrure NH2- , R-NH- : amidure HS- : hydrogénosulfure I3- : triodure CN- : cyanure R-C=C- : alcynure ...
O22- peroxyde OH- hydroxyde O3- ozonide
NO3- : nitrate SO42- : sulfate HPO42- : hydrogénophosphate CO32- : carbonate ClO3- : chlorate ClO4- : perchlorate
NO2- : nitrite ClO- : hypochlorite ClO2- : chlorite
Globalement, on rencontre pour les anions les suffixes ure, yde, ate, ite...
Les formules des composés binaires ioniques : (sels ou précipités)
Pour la formule , l'ordre est cation - anion, alors que dans le nom, en français, c'est l'inverse : anion de cation...(la formule provient de la dénomination en anglais) . Au laboratoire, les espèces sont classées dans les armoires par ordre alphabétique des cations (d'après leur formule)
KCl = K+,Cl- : chlorure de potassium
AgNO3 = Ag+,NO3- : nitrate d'argent
NaNO2 = Na+,NO2- : nitrite de sodium
NaClO = Na+,ClO- : hypochlorite de sodium ( HClO est l'acide hypochloreux)
NaClO2 = Na+,ClO2- : chlorite de sodium ( HClO2 est l'acide chloreux)
NaClO3 = Na+,ClO3- : chlorate de sodium ( HClO3 est l'acide chlorique)
NaClO4 = Na+,ClO4- : perchlorate de sodium ( HClO4 est l'acide perchlorique)
(NH4)3PO4 = 3NH4+, PO43- : phosphate d'ammonium
Hg2Cl2 = 2Hg+, 2Cl- : chlorure de mercure I ou chlorure mercureux ou CALOMEL
Fe(NO3)3 = Fe3+ , 3 NO3- : nitrate de fer III ou nitrate ferrique.
On remarquera pour les 4 espèces anioniques du chlore, l'ordre des dénominations des anions avec la succession hypo... ite/ ite / ate / per...ate que l'on retrouve pour d'autres espèces en fonction de l'ordre des états d'oxydation :
Cas des composés hydrogénés non ioniques
Les composés HX sont regardés comme des sels et donc prennent leur nomenclature :
HBr : bromure d'hydrogène HF : fluorure d'hydrogène
mais aussi , par extension H2S : sulfure d'hydrogène
Beaucoup de composés ont des nomenclatures historiques...
eau H2O, ammoniac NH3, hydrazine N2H4 , phosphine PH3...
Parfois, la détermination est faite à l'aide du suffixe ane particulièrement pour des composés dont l'H est polarisé négativement sans être toutefois un hydrure complet...
trisilane : Si3H8
diborane : B2H6 mais aussi hydrure de bore (comme si ionique)
Souvent , ils portent un nom lié à leur acidite :
H2SO4 / HSO4- / SO42- acide sulfurique / hydrogénosulfate / sulfate
H3PO4 / H2PO4- / HPO42- / PO43- acide phosphorique / dihydrogénophosphate/ hydrogénophosphate / phosphate
HNO3 / NO3- acide nitrique / nitrate
H2CO3 / HCO3- / CO32- acide carbonique / hydrogénocarbonate / carbonate
HIO4 / IO4- acide per iodique / per iodate
On rappelle ici que le première acidité de l'acide sulfurique et que l'acide nitrique sont INFINIMENT FORTS.
Composés de coordination ( atome central entouré de ligands ) ou complexes chargés ou neutres
Les formules répondent à la structure suivante :
[(atome central NO )n (ligands ioniques)p (ligands neutres)q ]
Les ligands sont donnés par ordre alphabétique du premier symbole des formules.
Les ligands anioniques porteront le suffixe o , les autres portent un nom spécifique...à connaitre, les exemples ci-dessous signalent les ligands le plus courants.
Les ligands neutres sont H2O ( aqua) , NH3 ( ammine avec 2 m) , CO (carbonyle) , en = ethylène diamine .
Le cation vient en fin de dénomination .
On remarquera qu'il y a la même inversion cation-anion dans la formule et anion cation dans le nom.
Exemples:
[PtII Cl2(H2O)(NH3)] : ammine aqua dichloro platine II
K3[FeII(CN)5(CO)] : carbonyle pentacyano ferrate II de potassium
[Al(H2O)6]Cl3 : Chlorure d'hexaaqua aluminium
[Co(en)3]2(SO4)3 : sulfate de tri(éthylène diamine) cobalt III
Co2(CO)8 : octocarbonyle dicobalt (complexe neutre du métal au NO = 0 )
En chimie minérale la nomenclature...manque de systématisme quant aux suffixes...