( sujet difficile )
Intro
I-Définitions
1/ Effet inductif
2/ Effet mésomère
II- Effets inductifs et mésomères en réactivité
1/ Création d'un site réactif
2/ Stabilisation par effets mésomères ou inductifs
III- Exemples de réactions
1/ Additions sur les alcènes, polyadditions
2/ SE sur les aromatiques
3/ Aldolisations et Test à l'iodoforme
Conclusion
En version
plus
développée...
Intro :
Invoqués à toute occasion en chimie, ces effets sont à la source des justifications de régiosélectivité en particuler.
I-Définitions
1/ Effet inductif
Une liaison peut être polarisée en raison d'une différence d'électronégativité entre 2 atomes : C - Cl , C - MgBr , C - CF3 . Cette polarisation, donc l'effet peut se faire sentir à travers 3 liaisons de façon sensible, peut entrainer certaines propriétés chimiques, ou réactivités, ou stabilités relatives . On parle de l'effet inductif, relatif à la déformation des liaisons.
2/ Effet mésomère
La représentation de lewis est insuffisante pour représenter certaines espèces. Pour compenser cette insuffisance, on est amené à proposer plusieurs écritures pour une même entité chimique, appelées formes mésomères. Des propriétés chimiques ou réactivités, ou stabilités relatives, découlent de la multiplicité des écritures. On parle alors d'effet mésomère.
II- Effets inductifs et mésomères en réactivité
1/ Création d'un site réactif
- Centre électrophile ou nucléophile :
R-MgX efffet inductif attracteur de C/Mg => C nucléophile
α-énone : C(2) électrophile par effet inductif + mésomère ; C(4) électrophile par effet mésomère
- Acido-basicité
ester + H+ : fixation sur le O de C=O par effet mésomère...
R-Cl soumis à une base forte à chaud : attaque du H en α rendu acide par la présence de l'halogène...mécanisme E2 présenté ...
Liaison avec le § suivant : des effets mésomères peuvent stabiliser la base conjuguée => H acide => stabilisations
2/ Stabilisation par effets mésomères ou inductifs
- Comparaison de la stabilité des carbocations et des carbanions : effet inductif donneur des alkyls ( stabilisent les C+ et déstabilisent les C- , exemples) , effet stabilisant majoritaire de la délocalisation => effet mésomère toujours > effet inductif . Voir ICI
- Montrer les réarrangements possibles de carbocations qui découlent de ces effets inductifs ou méomères de stabilisation :
- Stabilité des alcènes : Un alcène conjugué (effet mésomère) est plus stable qu'un alcène tétrasubstitué , plus stable que trisubstitué, plus stable que di...etc...( effet inductif donneur des alkyles déstabilisant ) .
III- Exemples de réactions
1/ Additions sur les alcènes, polyadditions
Les additions radicalaires, électrophiles ou nucléophiles sur les alcènes sont régiosélectives sous contrôle cinétique : on passe par l'IR le plus stable :
Exemples :
- polymérisation anionique du styrène par addition nucléophile ( carbanion le plus stable près du benzène -effet mésomère- )
- addition électrophile de HBr sur l'isobutène ( 2 méthyl pro 1 ène ) : carbocation le plus stable par effet inductif ( mentionner Markownikoff) , montrer l'effet mésomère supérieur sur un autre exemple : voir ICI
- Addition radicalaire de HBr sur l'isobutène : Montrer le résultat inverse. Mentionner Karash . Mentionner la polymérisation radicalaire du styrène ( effet mésomère )
Ecrire la première étape sur l'anisole et sur le nitro benzène . Montrer l'effet méomère donneur sur l'anisole et mésomère / inductif attracteur sur le nitro benzène et mentionner l'orientation majoritaire qui en résulte .
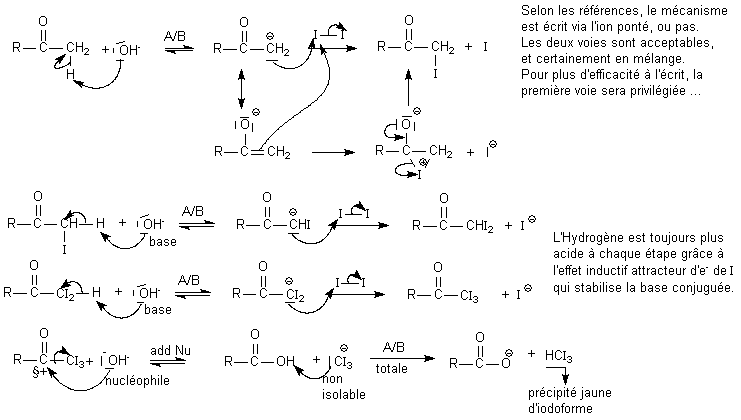
3/ Aldolisations et Test à l'iodoforme
Montrer la régiosélectivité de l'aldolisation sur la 1 phényl propanone avec l'éthanal par exemple . Mentionner l'effet mésomère favorable en position 1 => C1 nucléophile formé. Donner le produit formé.
Montrer le test à l'iodoforme sur une cétone méthylée : choisir la 3 méthyl butanone :
Le mécanisme complet est rappelé ci-dessous mais il ne faut pas l'écrire en entier :
- Mentionner le choix du 1° H acide => cabanion .
- L'aspect ion ponté n'a aucune importance ici...Effacer le carbanion et fixer I à la place
- Mentionner l'effet inductif attracteur de I favorable à la formation du carbanion au même endroit => carbanion => 2° puis 3° I
- Mentionner la liaison C -C fragile grâce à l'effet inductif => rupture . Donner les produits finaux
Conclusion
Les effets mésomères et inductifs sont des effets mentionnés dans la description des mécanismes sous le modèle de Lewis, dans le modèle des OM, ces notions ne sont plus évoquées, mais les modèles sont compatibles et complémentaires.