Le proton sera dans toutes les réactions écrit sous la forme H+ , écriture plus que conseillée dans un souci de rapidité d'exécution...on sait que le proton est solvaté, on le sait, sans avoir besoin de l'écrire !
I- Origine de la méthode
1/ Définitions
On rappelle que pour toute réaction chimique on peut définir une variation d'enthalpie libre standard de réaction ΔrG°(T), valeur numérique indépendante de la réalisation chimique de l'équilibre, dont la valeur peut être trouvée dans les tables.
On rappelle que pour tout équilibre , on peut définir une constante K(T) = exp ( -ΔrG°(T) / RT ) , valeur éventuellement listée dans des tables . Ces valeurs listées correspondent à des équilibres d'un même type , bien défini :
Certains équilibres d'un même type portent des noms, comme leur constante associée, qu'il faut impérativement connaître :
Autoproptolyse de l'eau Eq acido / basique Dissociation globale d'un complexe Dissociation successive d'un complexe Solubilité H2O = H+ + OH- HA = H+ + A- M(L)nm+ = Mm+ + n L M(L)nm+ = M(L)n-1m++ L
M(L)n cr = Mm+ + n Lp-
( avec nxp = m )Ke = 10-14 constante d'autoprotolyse Ka constante d'acidité Kd constante de dissociation du complexe Kdn constante de dissociation successive Ks produit de solubilité - définie aussi bien pour caractériser la base A- que l'acide HA, dans le sens de la dissociation de l'acide ( ici constante globale de dissociation, parfois notée β) (du complexe à n ligand) toujours défini pour donner l'ion métallique "libre" et le ligand intact, tel que dans le complexe.
2/ Combinaison de réactions
Selon les conditions expérimentales, les réactions prépondérantes en solution aqueuse ne sont pas forcément celles qui sont listées dans les tables, mais néanmoins, elles sont des combinaisons linéaires de ces dernières.
Or , comme les enthalpies libres standard de réaction sont des fonctions extensives, on peut calculer l'enthalpie libre standard de réaction d'une combinaison linéaire de réaction , en faisant la même combinaison linéaire des enthalpies standard.
Comme les constantes sont des exponentielles de variation d'enthalpie standard de réaction, la constante d'une combinaison linéaire de réaction , est le produit assorti de puissances égales aux coefficients de la combianison linéaire, des constantes de chacune des réactions constituant la combinaison...
LOURD, me direz-vous ??? ....voui...mais simple dans l'application !!!
Soit la combinaison linéaire suivante : (R) = 2 (2) - 2 (3) - (1) avec
(1) Ag(NH3)2+ = Ag+ + 2 NH3 ΔrG°(T)1 Kd
(2) NH4+ = NH3 + H+ ΔrG°(T)2 Ka
(3) H2O = H+ + OH- ΔrG°(T)3 Ke
(R) 2 NH4+ + Ag+ + 2 OH- = Ag(NH3)2+ + 2 H2O
(R) = 2 (2) - 2 (3) - (1) => ΔrG°(T)R = 2 ΔrG°(T)2 - 2 ΔrG°(T)3 - ΔrG°(T)1 => K = Ka2Ke-2Kd-1 = Ka2 trouvée...!! Ke2Kd
II- Méthode
Le souci est que , en général la combinaison linéaire ne vous est pas donnée , il faut la trouver...
1/ Analyse exprimée de la réaction
Reprenons l'exemple précédent :
2 NH4+ + Ag+ + 2 OH- = Ag(NH3)2+ + 2 H2O
acide dissocié complexe formé eau formée
Il faut rechercher dans cette réaction les réactions élémentaires listées ( celles pour lesquelles vous avez des données ) . Pour ce faire, on commence par analyser en français, le processus de transformation qui est présenté dans ce bilan.
- On constate qu'on forme le complexe Ag(NH3)2+ à partir de Ag+ : la réaction de dissociation intervient donc dans le sens indirect, donc Kd au dénominateur
- On constate que l'acide NH4+ se transforme en NH3 ,( ligand , prisonnier du métal ) : la réaction d'acidité de l'ammonium intervient . On constate que cette réaction d'acidité de NH4+ intervient pour 2 NH4+ , donc 2 fois , donc Ka au carré au numérateur
- On constate que l'on forme 2 molécules d'eau à partir de 2 OH- et des 2 protons (libérés par les deux acides NH4+) : l'autoprotolyse de l'eau intervient donc 2 fois, dans le sens indirect , donc Ke au carré au dénominateur donc....
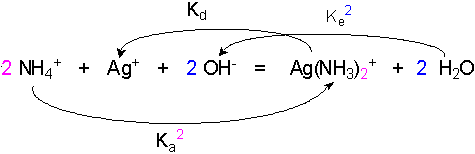 | donc K = Ka2 / Kd Ke2 |
Toute transformation se produisant dans le sens direct (sens de la lecture , cad de gauche à droite ) , intervient au numérateur de l'expression de K , à la puissance nécessaire , alors que toute réaction reconnue , se produisant dans le sens indirect (sens inverse du sens de la lecture , de droite à gauche ) , intervient au dénominateur dans l'expression de K
Ruse mnémotechnique :
Pour suggérer le numérateur , les flèches écrites dans le sens direct sont écrites au dessus de la réaction.
Pour suggérer le dénominateur , les flèches écrites dans le sens indirect sont écrites au dessous de la réaction.
L'écriture des flèches se fait avec la formulation mentale des phrases exprimées lors de l'analyse du 1/ . Les réactions cherchées dans le bilan, sont bien sûr les réactions pour lesquelles vous avez des données dans le texte.
3/ Autres exemples
Soit la dissolution du sulfure mercurique HgS solide . Très difficile , elle s'opère en milieu acide et iodure :
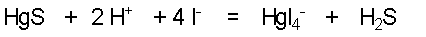
Données : Ks de HgS , Kd de HgI42- , pKa1 et pKa2 de H2S
Analyse "en français" :
- le solide HgS se dissout => Ks intervient , dans le sens direct, au numérateur
- Le complexe HgI42- se forme => Kd intervient , dans le sens indirect, au dénominateur
- Le diacide H2S se forme à partir des ions sulfure du solide et de H+ introduit : les deux constantes d'acidité interviennent , dans le sens indirect, au dénominateur donc...
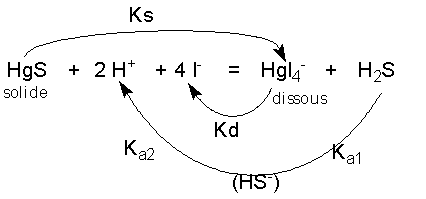 | donc K = Ks / ( Kd Ka1 Ka2 ) |
Soit le dosage de l'ion magnésium en milieu ammoniacal par l'EDTA :
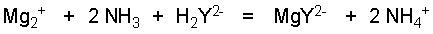
Données : Ka de l'ammoniac , tous les pKa de H4Y ( indicés de 1à4) Kd du complexe MgY2-
Analyse "en français" :
- Le complexe se forme dans le sens direct => Kd intervient , dans le sens indirect, au dénominateur
- L'acide NH4+ se dissocie dans le sens indirect , 2 fois => Ka intervient , au carré, dans le sens indirect, au dénominateur
- Le diacide H2Y2- se dissocie et fournit le ligand Y4- , en perdant 2 protons => Ka3 et Ka4 interviennent , dans le sens direct au numérateur donc...
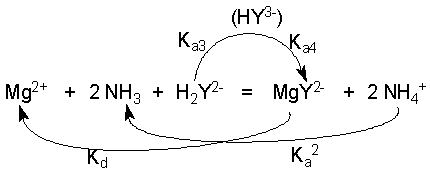 | donc K = Ka3Ka4 / Ka2Kd |
Soit la dissolution du calcaire (solide) en milieu acide. On constate le dégagement gazeux de dioxyde de carbone :
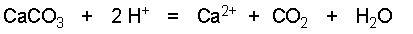
Données : Les Ka1 et Ka2 de l'acide carbonique H2CO3 , Ks de CaCO3 et K , constante de dissociation de H2CO3 en CO2 gazeux et eau
Analyse "en français" :
- CaCO3 se dissout => Ks intervient, dans le sens direct, au numérateur
- Le gaz CO2 est obtenu par décomposition de l'acide carbonique : K intervient , dans le sens direct au numérateur
- Cet acide carbonique a été formé par action de H+ sur la dibase CO32- libéré par la dissolution du solide : Le diacide H2CO3 se dissocie donc dans le sens indirect : Ka1 et Ka2 interviennent donc dans le sens indirect, au dénominateur
- l'autoprotolyse de l'eau n'intervient pas, c'est la décomposition de H2CO3 qui produit l'eau.
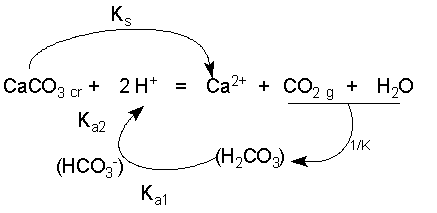 | donc K = Ks K / Ka1Ka2 |
Soit la redissolution de l'hydroxyde d'aluminium en milieu très basique:
Al(OH)3 + OH- = Al(OH)4-
Données : Ks de l'hydorxyde d'aluminium et Kd du tétra hydroxy aluminium III
Analyse "en français" :
- Le précipité se dissout => Ks intervient dans le sens direct , au numérateur
- Le complexe se forme => Kd intervient, dans le sens indirect, au dénominateur donc K = Ks / Kd
Je vous invite à pratiquer cette méthode , pour acquérir aisance et rapidité ( le schéma avec flèche devient éventuellement superflu ) sur les exemples proposés dans les exercices...
Adapter la méthode si les constantes de formation des complexes vous sont données...ce doit être simple !!...
D'autres exemples sont proposés dans la page : méthode de la réaction prépondérante , pour des réaction A/B