Ecrire le bilan de matière et revenir au 1°
La réaction est du type A + B = A + B et donc K = 1
Macroscopiquement, il ne se passe rien : tout ce qui a été mélangé reste en l'état...dans les quantités introduites. Le système est à l'équilibre thermodynamique. Il suffit d'appliquer n'importe quelle LAM traduisant l'équibre relatif aux espèces de votre choix pour trouver votre inconnue...
K<102 La réaction écrite modifie les quantités introduites: faire un bilan de matière adapté à la valeur de K:
Si K est proche de 102 L'avancement est proche de la valeur de l'espèce en quantité limitante (Hypothèse) , qui devient l'inconnue epsilon. Faire le bilan de matière et appliquer la LAM relative à cet équilibre pour trouver l'inconnue. A partir de ce résultat, éventuellement rapporter ces valeurs dans une autre LAM de votre choix pour trouver l'inconnue du problème. Vérifier l'hypothèse.
Si K est inférieur à 10-2 Pour des réactions A/B "standard" , la résolution de l'équation habituelle qui permettrait de trouver l'avancement à l'équilibre faite des dizaines de fois par des générations de chimistes montre que la réaction peut-être considérée comme très peu avancée. L'avancement epsilon peut être négligé devant des valeurs ordinaires...(mais pas devant 0 !) ( hypothèse) . L'équation à résoudre devient du 1° degré.
Faire le bilan de matière et appliquer la LAM relative à cet équilibre pour trouver l'avancement. A partir de ce résultat, éventuellement rapporter ces valeurs dans une autre LAM de votre choix , sans même écrire la réaction associée, pourvu que l'équilibre soit réalisé dans le système, pour trouver l'inconnue du problème. Vérifier l'hypothèse.
Si K est compris entre 10-2 et 102
Faire un bilan de matière sans rien négliger et appliquer la LAM relative à cet équilibre pour trouver l'avancement (Résoudre l'équation du second degré ). A partir de ce résultat, éventuellement rapporter ces valeurs dans une autre LAM de votre choix pour trouver l'inconnue du problème.
Quelles sont les espèces réellement mises en solution?
Toute espèce présentée dans le texte, telle quelle, ou dissociée par une réaction totale de dissoution, mais en aucun cas qui serait obtenue par un équilibre , même si vous savez qu'il aura forcément lieu. Tout se raisonne comme si le mélange était figé, sauf dissolution totale . En solution aqueuse...il y a de l'eau !!!!
Soit une solution aqueuse de chlorure d'ammonium ( NH4Cl).
Elle contient de l'eau H2O , NH4+ , issus de la dissolution totale du chlorure d'ammonium (sel) .
Elle ne contient pas les ions H3O+, ou OH- , fabriqués par l'autoprotolyse de l'eau, et qui est une réaction A/B Elle ne contient pas NH3 qui serait produit par l'action A/B de NH4+ sur l'eau
Les ions chlorure, sont des ions spectateurs inertes en pH et ne sont pas mentionnés.
Soit une solution d'acide nitrique (HNO3) et d'acide acétique (CH3COOH) de pKA = 4,5
Elle contient de l'eau H2O , H+ issu de la dissolution totale de l'acide infiniment fort HNO3 , et CH3COOH
Elle ne contient pas les ions OH- , fabriqué par l'autoprotolyse de l'eau, et qui est une réaction A/B
Elle ne contient pas CH3COO- qui serait produit par l'action A/B de CH3COOH sur l'eau
Les ions nitrate ( NO3-) sont des ions spectateurs inertes en pH et ne sont pas mentionnés.
Soit une solution d'acide sulfurique (H2SO4) ( pKA (HSO4-/SO42-) = 2 ) et d'acétate de sodium (CH3COONa) (pKA (CH3COOH/CH3COO- ) = 4.5
Elle contient H2O , H+ et HSO4- issus de la dissolution totale de l'acide infiniment fort H2SO4 , et CH3COO- issu de la dissolution totale de l'acétate de sodium.
Elle ne contient pas les ions OH- , fabriqué par l'autoprotolyse de l'eau, et qui est une réaction A/B
Elle ne contient pas CH3COOH qui serait produit par l'action A/B de CH3COO- sur l'eau
Elle ne contient pas SO42- qui serait produit par l'action A/B de HSO4- sur l'eau
Les ions sodium ( Na+), sont des ions spectateurs inertes en pH et ne sont pas mentionnés.
Le classement des espèces et détermination de la RP: trois exemples
Remarque : les pKA des couples de l'eau sont supposés connus ! ( 14 et 0)
Exemple 1 :
Soient les espèces présentes : H2O , CH3COOH , NH4+ et BO2-
Données : pKA (CH3COOH/CH3COO- ) = 4.5
pKA (NH4+/NH3) = 9,2
pKA (HBO2/BO2-) = 9,3
Version tableau
|
Version
axe
Acides Bases ¦ H2O 14 ¦ OH- ¦ HBO2 9,3 ¦ BO2- NH4+ 9,2 ¦ NH3 ¦ CH3COOH 4,5 ¦ CH3COO- ¦ ¦ H3O+ 0 ¦ H2O |
Conclusion : La RP a lieu entre l'acide de plus faible pKA CH3COOH et la base de plus fort pKA BO2- . Le choix se fait sans état d'âme car les différences entre les pKA dans chaque colonne sont parfaitement marquées . On considère qu'il faut un delta pK minimum de 2 pour conclure qu'un acide ( ou une base ) est nettement plus fort(e) qu'un(e) autre...
Dans la version tableau , les produits obtenus sont les espèces conjuguées de CH3COOH acide et BO2- base
Dans la version axe, on peut appliquer ce que l'on appelle la règle du gamma pour lire les espèces obtenues.
Soit CH3COOH + BO2- = HBO2 + CH3COO-
OUi, MAIS, si delta pK est plus faible que 2 ??? :
Exemple 2 :
Soient les espèces présentes : H2O , CH3COOH, NH3 et BO2-
Données : pKA (CH3COOH/CH3COO- ) = 4.5
pKA (NH4+/NH3) = 9,2
pKA (HBO2/BO2-) = 9,3
Version tableau
|
Version
axe
Acides Bases ¦ H2O 14 ¦ OH- ¦ HBO2 9,3 ¦ BO2- NH4+ 9,2 ¦ NH3 ¦ CH3COOH 4,5 ¦ CH3COO- ¦ ¦ H3O+ 0 ¦ H2O |
Conclusion : Les bases NH3 et BO2- sont d'une force équivalente, alors que l'acide acétique est définitivement l'acide le plus fort. Il faut donc tenir compte de 2 RP , ayant lieu simultanément.
CH3COOH + BO2- = HBO2 + CH3COO-
CH3COOH + NH3 = NH4+ + CH3COO-
Il faut donc mener deux bilans de matières simultanés.
Exemple 3 :
Soient les espèces présentes : H2O, et HS-
Données : H2S : pKA1 = 7 ; pKA2 = 13
que l'on peut immédiatement traduire par : H2S ¦ HS- ¦ S2- 7 13 pH
qui montre que HS- est un ampholyte, à la fois acide et base
Version tableau
|
Version
axe
Acides Bases ¦ H2O 14 ¦ OH- HS- 13 ¦ S2- ¦ ¦ H2S 7 ¦ HS- ¦ ¦ ¦ H3O+ 0 ¦ H2O |
Conclusion : HS- acide ne peut être négligé par rapport à H2O acide , alors que HS- base est définitivement la plus forte. Donc , il faudra tenir compte de 2 RP :
H2O + HS- = OH- + H2S
HS- + HS- = S2- + H2S aussitôt remplacée par 2HS- = S2- + H2S
( écriture indispensable à l'établissement
d'un bilan de matière "serein")
....et établir un bilan avec deux équations simultanées.
Le calcul de la constante d'une réaction :
Rappels :
Ke = 10-14 est la constante de la réaction 2 H2O = H3O+ + OH- ou H2O = H+ + OH-
La réaction de "définition" du caractère Acide d'une espèce est du type :
AH
= A-
+ H+
de constante KA par définition
ou H2O
+ AH = A-
+ H3O+
de même constante KA par définition
Comme AH = A- + H+ est de constante KA par définition alors
A- + H+ = AH est de constante (1/ KA ) par définition
Si une réaction est une combinaison linéaire de réactions , alors la constante est un produit des constantes des réactions sources.
Cas général
Or toute réaction A/B est
soit la réaction de "définition" du caractère acide d'une espèce , ou son inverse... de constante KA ou 1/KA
soit une réaction combinaison linéaire de différentes réactions de "définition"... : K = ?
Il est donc facile de trouver les constantes de toutes réaction chimique, simplement en analysant son bilan :
sens direct donc au numérateur
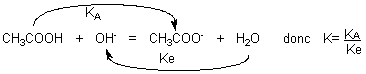
sens indirect donc au dénominateur
sens direct donc au numérateur
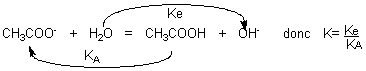
sens indirect donc au dénominateur
2 acidités successives dans le sens direct
donc produit des 2 KA au numérateur
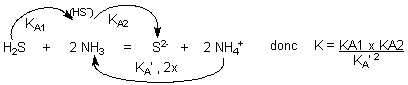
2 x la même réaction dans le sens indirect
donc carré au dénominateur
Cette méthode a pour but d'obtenir rapidement et efficacement la valeur des constantes d'équilibres écrites.
Elle se généralise à la détermination de toute constante d'équilibre en solution aqueuse.
Les bilans de matière et application de la LAM
Exemple 1
La première RP d'un problème est la suivante :
CH3COOH + BO2- = HBO2 + CH3COO- K = 104,8 : HYPOTHESE TOTALE
EI 0,3 0,2 0 0 donc avancement = 0,2 (qtté de réactif limitant)
EF 0,1 0 0,2 0,2
La RP suivante (application de la méthode, on revient au point 1° )
CH3COOH + CH3COO- = CH3COOH + CH3COO- K = 1 et ne change rien au bilan précédent
donc [CH3COOH ] = 0,1 mol.L-1 et [ CH3COO- ] = 0,2 mol.L-1
Pour calculer le pH j'applique de façon opportuniste la LAM réalisée dans le milieu de mon choix qui permettra de calculer le pH...soit
KA
=
[ CH3COO- ][H+]
[CH3COOH ]
[CH3COOH ]
dont
la seule inconnue est [H+]...
Exemple 2
H2O + BO2- = HBO2 + OH- K = 10-4,7 : HYPOTHESE PEU AVANCEE
EI solvant 0,1 0 0 notons l'avancement £, négligeable devant 0,1
EF solvant 0,1 - £ £ £
On applique la LAM : K = 10-4,7 = £2
0,1 On en déduit [OH- ] = 10-2,85 donc par la LAM relative à Ke : pH = 11,15
( opportunisme )
Exemple 3
NH3 + HBO2 = NH4+ + BO2- K = 10-0,1 : PAS d' HYPOTHESE
EI 0,1 0,2 0 0
On applique la LAM : K = 10-0,1 = [NH4+][BO2-] et on en déduit x
[NH3][HBO2]
On applique alors de façon opportuniste une autre LAM réalisée dans le milieu , par exemple
KA ( NH4+/NH3) = (0,1-x)([H+]
x
On trouve bien sûr le même résultat en utilisant le KA de l'autre couple...
Cas particulier des ampholytes :
La RP est forcément : 2 HA- = H2A + A2- K = KA2/KA1 ( tjs < 102 ), pas d'hypothèse...
EI c 0 0
EF c-2x x x
Ruse : il est alors pratique d'exprimer le produit de 2 LAM : KA1 . KA2 = [HA-][H+].[A2-][H+]
[H2A] . [HA-]
= (c-2x)[H+] . x[H+] = [H+]2
x . (c-2x)
On retrouve dons la fameuse expression à connaître :
Une solution d'ampholyte dans l'eau a un pH qui vaut 1/2 ( pKA1 + pKA2 )
Les bilans simultanés :
Un tableau bilan simultané se mène de deux façons possibles :
Version débutant :
Ecrire les 2 réactions simultanées :
Faire le listing de toutes les espèces intervenant dans les réactions simultanées, écrites une seule fois.
Faire une première ligne EI
Faire une deuxième ligne : avancement par la première réaction
Faire une deuxième ligne avancement par la deuxième réaction
Calculer la dernière ligne en sommant les 3 précédentes : c'est l'état final :
Exemple :
CH3COOH + BO2- = HBO2 + CH3COO- K1
CH3COOH + NH3 = NH4+ + CH3COO- K2
| CH3COOH | BO2- | HBO2 | CH3COO- | NH3 | NH4+ | |
| EI | C1 | C2 | 0 | 0 | C3 | 0 |
| par 1 | -x | -x | +x | +x | . | . |
| par 2 | -y | . | . | +y | -y | +y |
| EF | C1-(x+y) | C2-x | x | x+y | C3-y | y |
On a alors deux inconnues pour deux LAM à écrire ...pas de problème...Toutefois, le problème mathématique se simplifie particulièrement bien si les réactions sont peu avancées...On néglige alors x , y , et même (x+y) devant Ci...et les équations deviennent : K1 . C1 . C2 = x . ( x+y)
K2 . C1 . C3 = y . ( x+y )
en sommant K1 . C1 . C2 + K2 . C1 . C3 = (x+y)2 facile alors de trouver (x + y ) , puis x ou y
Dans une autre LAM choisie de façon opportuniste, on reporte les valeurs touvées pour déterminer [H+] et donc le pH !
Version "pro"....
On établit deux tableaux "ordinaires" , un par réaction, en n'oubliant pas de reporter toute modification faite à une espèce commune aux deux réactions dans l'autre réaction :
| CH3COOH + BO2- = HBO2 + CH3COO- | CH3COOH + NH3 = NH4+ + CH3COO- | |
| EI | C1 C2 0 0 | C1 C3 0 0 |
| EF | C1-x -y C2-x x x + y | C1-x -y C3 -y y x + y |
Les calculs se mènent comme précédemment...