Intro
I- Les réactions renversables
1/ L'acétalisation
2/ Formation d'amide
3/ Williamson
4/ Diels Alder
II- Les suites réactionnelles
1/ Protection d'un aldéhyde / action sur une cétone
2/ Protection d'une double liaison en bout de chaîne / autre double
Conclusion
En version plus
développée...
Intro :
Protéger une fonction revient à la rendre insensible momentanémant à des conditions expérimentales actives sur une autre partie de la molécule, pourla restituer intacte ensuite.
On peut utiliser des réactions en une étape pour la transformation , et en une étape pour la restitution, qualifiées ici de réactions reversables, par rapport à la fonction protégée.
On peut aussi utiliser des protocoles de synthèse plus complexes, dans des cas plus délicats.
Nous montrerons la protection en situation dans quelques exemples
I- Les réactions renversables
1/ L'acétalisation
L'acétalisation permet de protéger un carbonyle d'aldéhyde ou cétone de tous les milieux, sauf l'hydrolyse acide (qui régénère la fonction C=O )
Exemple :
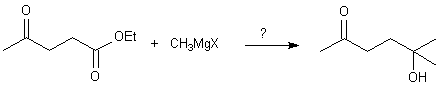
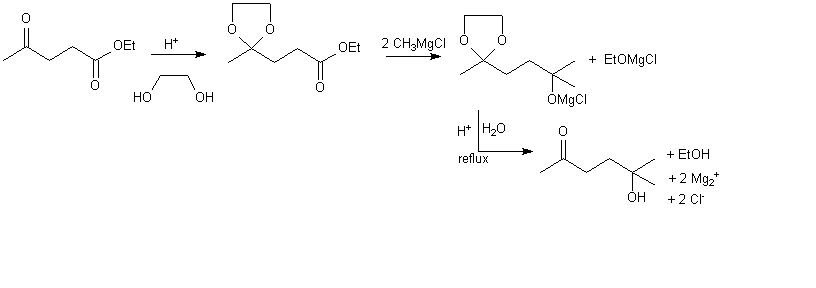
Il faut donc protéger la cétone , plus réactive , de l'action d'un organomagnésien : solution : l'acétalisation qui n'a pas lieu sur l'ester.
Inversement , l'acétalisation peut aussi protéger un diol , en le différentiant d'un alcool simple.
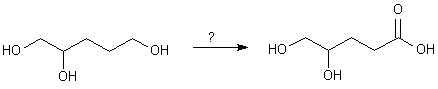
L'emploi de la propanone que l'on acétalise par le diol ci-dessus permet d'obtenir :
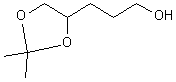 . L'oxydation de l'alcool terminal, suivi de l'hydrolyse acide de l'acétal donne le produit souhaité.
. L'oxydation de l'alcool terminal, suivi de l'hydrolyse acide de l'acétal donne le produit souhaité.2/ Formation d'amide
Les fonctions amines sont nucléophiles et basiques . On peut souhaiter les protéger pour agir par un électrophile sur une autre partie de la molécule.
Exemple :
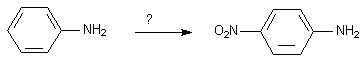
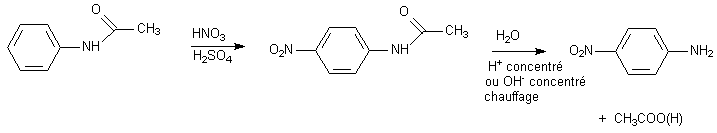
La nitration utilise un milieu TRES acide qui protonera la fonction -NH2 en NH3+ , qui orientera en para . D'autre part ce milieu est oxydant et Ph-NH2 est sensible à l'oxydation. Solution : formation d'une amide.
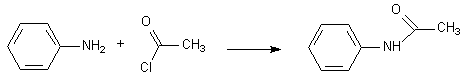
-NH-C=O , groupe amide, n'a aucune propriété basique par l'azote , et insensible aux oxydants . Il oriente toujours en ortho para .
Dans le même esprit , on pourrait protéger un groupe alcool, d'une oxydation, par une estérification . Mais les esters sont hydrolysables en milieu acide et basique, ce qui les rend moins performants par rapport à d'autres milieux.
3/ Williamson
Peut-être utilisée pour protéger des groupes alcools par formation d'éthers , très stables en tous milieux...le phénol est un candidat classique à cette protection, car sa base est très facilement obtenue :
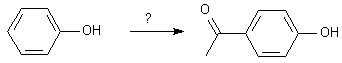
L'acide de Lewis AlCl3 , nécessaire à la réaction de Friedel et Craft, se complexe avec -OH , qui oriente alors en méta. -OH est activant, on pourrait éventuellement se passer du catalyseur...mais on aurait alors une estérification sur -OH...
Donc :
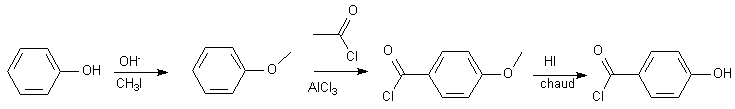 + CH3I
+ CH3I4/ Diels Alder
On mentionne que la réaction de Diels Alder est renversable par élévation de température (effet entropique ) . Elle est donc d'un emploi possible pour protéger un diène cis...
II- Les suites réactionnelles
1/ Protection d'un aldéhyde / action sur une cétone
Aldéhydes et cétones sont toutes deux sensibles à la réaction de Wittig, comme à l'acétalisation. Par contre les esters sont insensibles à Wittig ou à l'acétalisation :
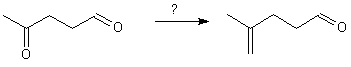
Nécessite une réaction de Wittig sur la cétone : Comment protéger l'aldéhyde ?
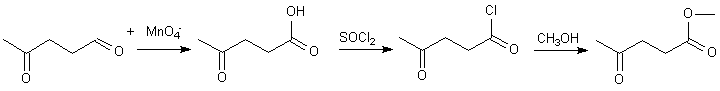
à ce stade , on constate que si l'on veut protéger la cétone par acétalisation, ce serait possible, on libèrerait alors l'aldéhyde comme ci-dessous (dernière étape) , pour n'agir que sur l'aldéhyde par Wittig par exemple...
Ci-dessous, on réalise Wittig sur la cétone :
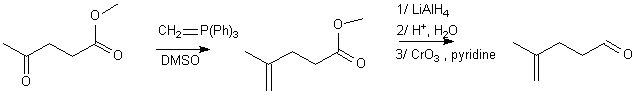
2/ Protection d'une double liaison en bout de chaîne / autre double
Une hydroboration en bout de chaîne permet de distinguer deux fonctions alcènes d'encombrement différent . Selon les conditions , une Williamson permettra de protéger cet alcool définitivement . On peut alors imposer tout traitement à l'autre fonction alcène, puis régénérer la double liaison terminale par HI, suivie d'une désyhydratation par l'acide sulfurique concentré à chaud .
Conclusion
Les réactions renversables sont particulièrement précieuses puisqu'elles minimisent les pertes de rendement, imposées par des suites réactionnelles, parfois très intéressantes intellectuellement, mais rendant le produit synthétisé de plus en plus couteux ...
Une synthèse doit donc quand cela est possible trouver un ordre réactionnel qui évite ces protections, mais ce n'est malheureusement pas toujours possible, particulièrement en pharmacie, quand il s'agit de modifier une molécule naturelle complexe.