Intro
I- Réactions entre 2 fonctions différentes
1/ Substitution
- -a- SN
- -b- SE
- -a- Aldocétolisation
- -b- Addition / élimination
- -c- Réarrangements d'alcènes
- -d- Acétalisation
1/Formation d'époxydes
2/Diels Alder
Conclusion
En version plus
développée...
Intro :
2 sites réactifs sur la même molécule, toutes réactions a priori possibles mais problèmes majeurs : probabilité de rencontre et gêne stérique
Il existe des réactions spécifiques comme Diels Alder
I- Réactions entre 2 fonctions différentes
1/ Substitution
- -a- SN
- 4-iodo butane-1- ol cycle à 5 centres dont 1 O en présence de Na dans l'éther. Mécanisme SN2 , probabilité de rencontre max car cycle à 5 centres et facile car cycle stable.
- 2-chloro éthane1-ol : idem mais cycle à 3 centres , instable ; cycle à 4 centres "impossible", cycle à 7 ou 8 centres ou plus "impossibles" par cette méthode
- Citer la déshydratation intramoléculaire de diols --> éther cyclique
7 iodo heptane 2 one en milieu basique : base la plus stable donne cyle à 7 : ne se fait pas, base la moins stable donne cycle à 5 majoritaire
- -b- SE
Si on a le même réactif avec −(CH2)4− , la réaction inter moléculaire devient majoritaire.
2/ Additions
- -a- Aldocétolisation
- -b- Addition / élimination
Obtention d'une amide cyclique à partir d'un acide amoiné bien choisi. Compétition avec la polymérisation...
Obtention d'un anhydride cyclique par déshydratation d'un diacide.
- -c- Réarrangements d'alcènes
Soit la molécule suivante :
 (On remarquera l'alternance "double / 3 simples / double /... )
(On remarquera l'alternance "double / 3 simples / double /... )On peut en faire un carbocation après époxydation de la 1° double liaison , puis ouverture en milieu acide :
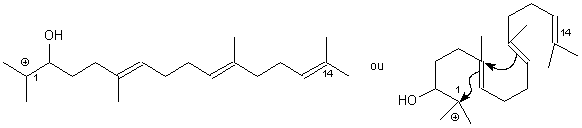
Le 1° carbocation qui se forme est le plus stable, l'ouverture de la 1° double liaison donne aussi le carbocation le plus stable, formant un cycle à 6 centres, l'ouverture de la 2° double liaison , selon le même principe, donne un cycle à 5 centres :
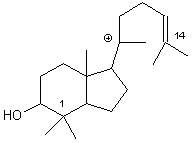 L'ouverture de la 3° liaison ne se fait pas : elle donnerait un cycle à 4 centres.
L'ouverture de la 3° liaison ne se fait pas : elle donnerait un cycle à 4 centres. Ce carbocation évolue en perdant un proton (avec réarrangements ) pour donner une molécule bicyclique à 2 doubles liaisons.
La synthèse de stéroïdes se fait naturellement et en laboratoire selon ce principe .
Remarque : cette synthèse est peut-être difficile à retenir ...on peut faire un travail simplifié montrant simplement la formation d'un cycle à 6 centres par réaction intramoléculaire entre un carbocation et une double liaison...
- -d- Acétalisation
On pourrait aussi citer la réaction de Wittig, ou l'action d'un RMgX intramoléculaire...méthodes moins fréquentes.
II- Réactions spécifiques
1/Formation d'époxydes
Donner l'oxydation d'un alcène ...
2/Diels Alder
Présenter la réaction en donnant ses propriétés (contrôle orbitalaire, régiosélective et stéréospécifique...)
Conclusion
Quasiment toutes les réactions de création de liaison CC permettent d'obtenir des cycles à 5 et 6 centres.
Très difficile d'obtenir des cycles à 4 ou à plus de 6 centres. Prix nobel pour éthers couronnes de très grande taille .