Intro
I- Dosages colorimétriques
1/ Par précipitation
2/Par complexation
3/ Spectrophotométrie
II- Dosages potentiométriques
1/ Dosage redox
2/ Dosage par précipitation
3/ Pile de concentration
4/ Dosage pH métrique
III- Dosages conductimétriques
1/ Mesure absolue
2/ Par précipitation
Conclusion
En version
plus
développée...
Intro :
Différentes techniques sont à notre disposition pour doser les cations metalliques :
-> annoncer le plan
I- Dosages colorimétriques
1/ Par précipitation
Dosage de Ag+ : indicateur de fin de réaction AgCrO4 rouge sang. Méthode : Cl- (Co et Vo connus ) et CrO4- ( quelques gouttes ) dans le bécher, Ag+ ( C inconnue) à doser dans la burette.
(R)1 : Ag+ + Cl- = AgCl blanc
(R)2 : Ag+ + CrO4- = AgCrO4 rouge l'apparition de la couleur rouge marque donc l'équivalence du dosage de Cl- par Ag+ . Véq permet de déterminer C.
2/ Par complexation
Mg2+ par l'EDTA , en milieu tamponné à pH = 10 , en présence de NET pour visualiser l'équivalence. Voir TP
3/ Spectrophotométrie
Les cations métalliques sont souvent incolores. Complexés, ils peuvent être colorés .Utilisation de la loi de Beer Lambert qui traduit la proportionalité entre absorbance et concentration. En excès de ligand orthophénantroline , on réalise une droite d'étalonnage avec les solutions connues de Fe3+ par exemple, à la longueur d'onde maximale d'absorption..
On rajoute le ligand en excès dans la solution inconnue de Fe3+ à doser : lecture de A , report sur la droite d'étalonnage, détermination de la concentration .
II- Dosages potentiométriques
1/ Dosage redox
Dosage du sel de Mohr (Fe2+) par Ce4+ , Voir TP .
Montage : 2 électrodes : Pt et calomel , voltmètre entre les deux
Savoir préciser que avant l'équivalence, E est proche du potentiel standard E° de celui qui est dans le bécher au départ, et après l'équivalence, E est proche du potentiel standard E'° de celui qui est dans la burette => saut à l'équivalence.
2/ Dosage par précipitation
Dosage de Ag+ par halogénure : idem que I-1 mais pas de chromate : une électrode d'argent .
Ag+ dans le bécher, Cl- dans la burette :
Pendant la précipitation , le potentiel est élevé car il reste du Ag+ en quantité non négligeable.
Après l'équivalence, le potentiel est bas car [Ag+] est fixée par la LAM : Ks = [Ag+][Cl-] , avec Cl- en excès => [Ag+]= Ks/[Cl-] très faible
Pas de point anguleux car le précipité est toujours présent.
2/ Pile de concentration
Soit une pile avec d'un côté une solution étalon de l'ion à doser , et de l'autre, une la solution inconnue, avec une électrode du métal associé dans chaque bécher.
Epile = 0,06/n log ( Cétalon / C ) => C déterminé
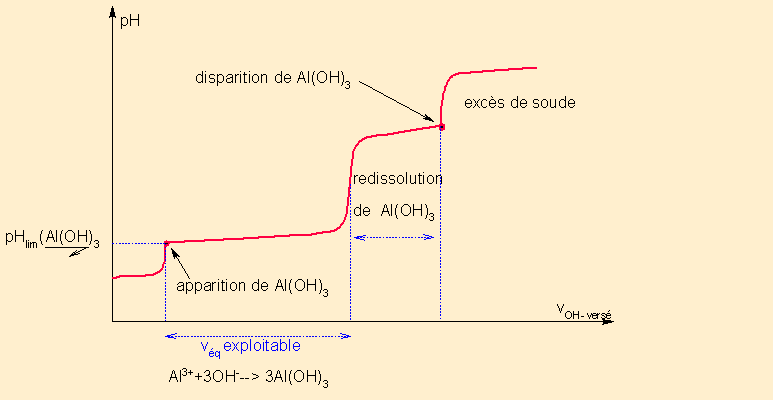
4/ Dosage pH métrique
Dosage de Al3+ par OH- .
1- La solution de Al3+ est acide ( Rappel les cation trivalents sont acides car forment des complexes avec l'eau qui perdent facilement un proton : Al(H2O)63+ = Al(H2O)5(OH)2+ + H+
2- RP1 : H+ + OH- = H2O
à l'équivalence , pH augmente, mais à pH limite , précipitation de Al(OH)3 : point anguleux
RP2 : Al3+ + 3 OH- = Al(OH)3
à l'équivalence, pH augmente fortement, puis palier. Pas de point anguleux.
RP3 : Al(OH)3 + OH- = Al(OH)4-
à l'équivalence , plus de précipité => point anguleux , puis brusque montée du pH et saturation.
La RP3 n'étant pas tout à fait totale, c'est le volume relatif à la RP2 qui est utile pour le dosage.
III- Dosages conductimétriques
1/ Mesure absolue
Après étalonnage du conductimètre, on mesure la conductivité d'une solution qui ne contient QUE l'ion à doser Mg2+ et contre ion SO42-:
σ = 2 x λMg2+ [Mg2+ ] + 2 x λSO42- [SO42- ] = 2 x ( λMg2+ + λSO42- ) x [ Mg2+]
Méthode peu adaptée au dosage car erreur importante
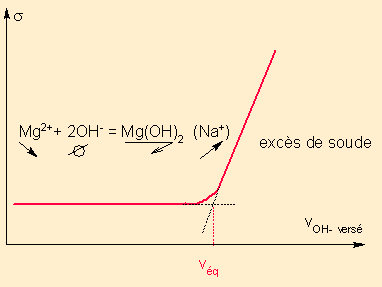
2/ Par précipitation
Même métal , dosé par précipitation , avec OH- par exemple :
Conclusion
Méthodes nombreuses. Il existe aussi la possibilité de mesurer des courants de diffusion d'électrolyse, proportionnels à la concentration en solution