Intro
I- Obtention de composés azotés
1/ à partir d'azote minéral
2/ à partir d'autres composés azotés organiques
II- Des fonctions plus ou moins fragiles
1/ Les hydrolyses
2/ L'élimination d'hoffmann ( hors programme)
III- Les bases azotées
1/ Résolution racémique
2/ Assistant basique en synthèse
Conclusion
En version plus
développée...
Intro : Listing de toutes les fonctions azotées organiques, très nombreuses
Amines, primaires , secondaires, tertiaires ( et ion ammonium quaternaire ) :
- CH3NH2 , méthylamine
- ((CH3)2CH) NH diisopropylamine
- N éthyl butanamide : C3H7-C(=O)-NH-C2H5
Nitriles : R-C=N
- éthanenitrile : CH3-C=N
- La 2,4 DNPH ( Di Nitro Phényl Hydrazine ) : (NO2)2 Ph - NH-NH2
On s'attachera ici à montrer l'essentiel de la chimie des amines, certaines réactions ne pouvant être que évoquées dans le temps imparti.
I- Obtention de composés azotés
1/ à partir d'azote minéral
- Les amines par la réaction d'Hoffmann
Montrer la difficulté de maitrise de la classe de l'amine obtenue, puisque les amines réagissent de la même façon que l'ammoniac.
- Les nitriles
- Les dérivées nitrés du benzène
2/ à partir d'autres composés azotés organiques
Les amides
- Acylation des amines : Amine + Chlorure d'acyle ou anhydride d'acide --> amide. Donner un mécanisme d'addition élimination
- Hydrolyse partielle et contrôlée d'un nitrile ( noter que cela reste difficile )
Réaction de polymérisation : diacide + diamine en chauffant pour éliminer l'eau --> polyamide , donner un motif.
L'aniline
- Réduction du groupe -NO2 en -NH3+ par l'action d'un métal réducteur ( Zn, Sn, Fe ) et HCl concentré. La neutralisation du milieu permet de récupérer l'aniline.
Les hydrazones et imines substituées
- Addition d'une amine sur C=O, à pH environ 5 --> imine substiuée
- Action de la 2,4 DNPH sur C=O des aldéhydes et cétones --> hydrazone précipitée orange, caractéristique par son point de fusion, du carbonylé de départ
1/ Les hydrolyses
Hydrolyse acide ou basique des amides, longuement et à chaud --> acide carboxylique + amine .
Rappeler l'intérêt en protection de la fonction amine : acylation = protection, hydrolyse = régénération.
L'hydrolyse dans les mêmes conditions d'un nitrile fournit l'acide carboxylique . R-C=N --> R-COOH
L'hydrolyse d'une imine hydrogénée (intermédiaire de la réaction de RMgX sur nitrile) est immédiate et fournit une cétone.
2/ L'élimination d'hoffmann ( hors programme)
Alors que les réactions d'élimination sur les dérivés halogénés , ou la déshydratation des alcools se font sous contrôle thermodynamique et fournissent l'alcène le plus stable, la réaction d'élimination d'Hoffmann se fait sous contrôle cinétique :
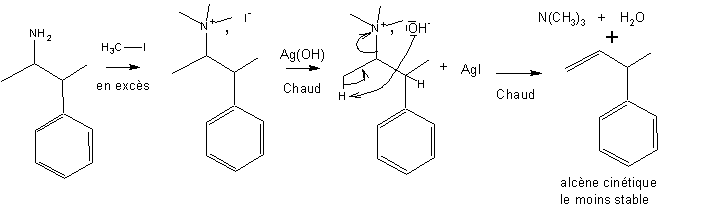
III- Les bases azotées
1/ Résolution racémique
Exemple précis : Voir cours
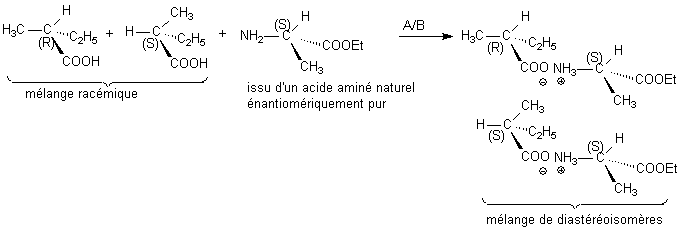
2/ Assistant basique en synthèse
Les amines basies faibles non nucléophiles : pKA = 10
Utilisation de la pyridine, ou de la triéthylamine comme base qui récupère un proton lors de certains mécanismes.
Exemple : action d'un alcool sur un chlorure d'acyle, pour éviter la formation de HCl
Les amidures bases fortes : pKA = 34
la LDA. Emploi pour la condensation aldolique par exemple, ou l'obtention d'un acétylure.
Conclusion : La chimie de l'azote est très riche et particulièrement importante pour la médecine et la pharmacie, puisque les protéines du vivant sont des polypeptides, et les acides aminés constituants principaux de ces protéines.