Intro
I- Structure à l'état standard
1/ Atome
2/ Graphite
3/ Diamant
4/ Equilibre Graphite / Diamant
II- Propriétés réductrices
1/ Les couples
2/ Diagramme d'Ellingham
3/ Utilisation en métallurgie
III- Les formes moléculaires minérales du carbone
1/ Dioxyde de carbone et acide carbonique
2/ L'ion cyanure
Conclusion
En version
plus
développée...
Intro :
La source naturelle du carbone est le dioxyde de carbone pour les plantes. Consommés par les êtres vivants, elles constituent la source de carbone de tout le vivant sur terre ( carbone organique ) .
Dégradées dans les couches profondes de la croûte terrestre, ces plantes peuvent conduire à des gisements de pétrole, de gaz ou sous forme de carbone natif : charbon , ou plus rare , diamant .
I- Structure à l'état standard
1/ Atome
C : Z = 6 1s2 2s2 2p2 => 4 liaisons possibles ; géométries rencontrées : linéaire ( CO2 ) , plan ( graphite ou CO32- ), tétraédrique ( diamant...)
M = 12 g/mol
Définition de la mole : nbre d'atomes dans 12 g de carbone = 6,02 . 1023
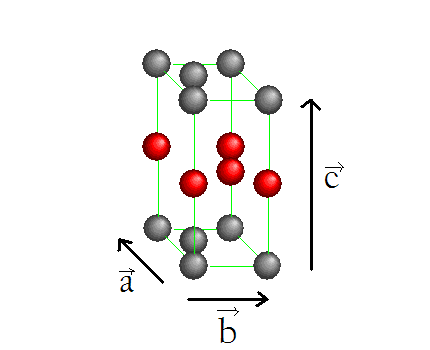
2/ Charbon
Structure cristallographique du charbon , maille.
 |
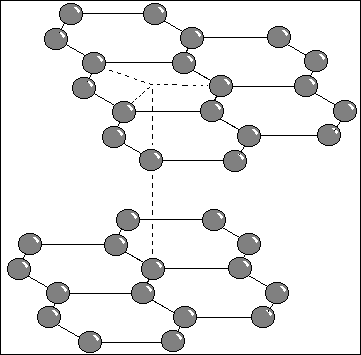 |
- conducteur d'électricité dans un plan => utilisation en électrodes ( électrolyses et moteurs )
- Plans mobiles les uns par rapport aux autres : lubrifiants, mais fragile ( cassant dans le plan perpendiculaire )
- Brillant car intéraction électrons "libres" / lumière
- densité = 2,2
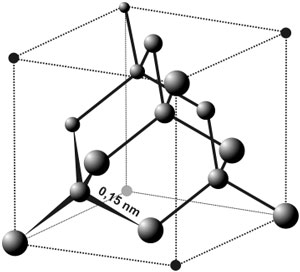
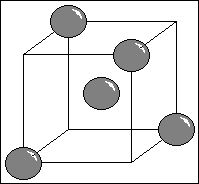
Structure cristallogaphique: cubique face centré + 1 site tétraédrique sur 2 , en diagonales alternées.
 |
 |
Conséquences :
- Cristal 100% covalent par liaisons σ=> TRES solide, TRES dur
- Transparent à la lumière ( électrons localisés dans les liaisons σ)
- Cassants selon des plan contenant le moins de liaisons ( plans de taille )
- inerte chimiquement, aucune conductibilité
- densité = 3,54
Cgraphite = Cdiamant établi pour égalité des potentiels chimiques :
l'écrire : μgraph(T,P) = μ°graph(T) + vm graph ( P-P°) = μdiam(T,P) = μ°diam(T) + vm diam (P-P°)
donc : μ°graph(T) - μ°diam(T) = ( vm diam - vm graph ) ( P-P°) or la comparaison des densités => vm diam < vm graph
donc : μ°graph(T) < μ°diam(T) le graphite est la forme stable du carbone natif.
On peut trouver, à T donnée, la pression nécessaire pour obtenir du diamant à partir de graphite ( TRES élevée)
II-Propriétés réductrices
1/ Les couples
- CO2/ C : C + O2 --> CO2 combustion exothermique du carbone ( carbone source d'énergie )
- CO / C : C + ½ O2 --> CO combustion partielle ( exothermique ) du carbone ( danger de CO et des chauffages au C )
- CO /CO2 : couple intermédiaire
Donner l'allure :
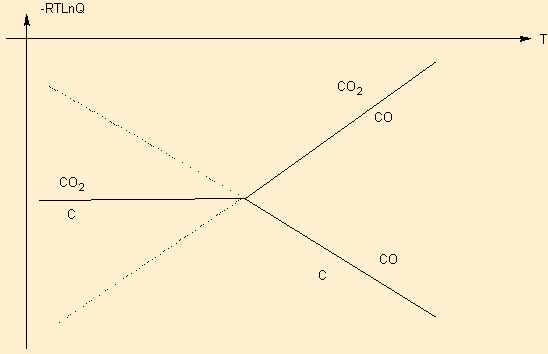 |
Mentionner la dismutation de CO, la décroissance exceptionnelle de la droite CO / C La croissance de toutes les autres dtes pour tous les autres couples et donc la prorpiété réductrice du C et son intérêt en métallurgie |
3/ Utilisation en métallurgie
Voir cours de pyrométallurgie sur Zn : placer la droite ZnO / Zn sur ce graphe et conclure . Mentionner la propriété réductrice de CO complémentaire. Rappeler les conditions de Température pour effectuer cette pyrométallurgie.
III-Les formes moléculaires minérales du carbone
1/ Dioxyde de carbone et acide carbonique
Les équilibres A/B
Ecrire l'équilibre de dissolution de CO2 dans l'eau et les couples A/B de H2CO3
Axe de prédominance des espèces ;
Carbonatation de la soude ;
Régulation du pH du sang ( HCO3- )
Précipitation des carbonates
Equilibre à l'origine de la formation des coraux ( carbonates )
Rappeler le test à l'eau de chaux pour détecter la présence de CO2 gaz .
Calcaire = carbonates précipités.
2/ L'ion cyanure
CN- , deuxième source minérale de C en chimie organique ; HCN gaz associé très toxique . Permet en chimie organique des SN , puis des hydrolyses pour allonger une chaîne carbonée.
Conclusion
Propos développement durable : l'activité humaine qui a utilisé le carbone fossile comme source d'énergie a produit une dérégulation du cycle du carbone ( augmentation de CO2 et pénurie de carbone fossile ) . Le carbone organique vivant ( plantes ) pourra être privilégié mais entraîne d'autres soucis ( gestion de l'eau et des terres à production alimentaires )