I- L' appareil de mesure potentiométrique au laboratoire
Que ce soit en pH-métrie ou en potentiométrie , l'appareil employé est un voltmètre

On remarquera par exemple sur ce voltmètre la double fonction pHmètre et voltmètre .
En fonction voltmètre, on lit la mesure brute de ddp, aucun étalonnage n'est nécessaire.
En fonction pH mètre, de l'électronique transforme la valeur numérique du potentiel par une fonction mathématique dont les paramètres sont réglables : un étalonnage est nécessaire, à l'aide de solutions tampon.
Or tout voltmètre mesure une DIFFERENCE de POTENTIEL ( ddp ) , entre deux électrodes. Le principe est d'avoir une électrode de potentiel fixe ( électrode de référence) et une électrode sensible à la concentration de l'entité chimique dont on souhaite suivre l'évolution en cours de réaction chimique.
Le choix des électrodes est donc une question préalable à toute utilisation d'un appareil de mesure potentiométrique
II- Les différentes électrodes
1- Les électrodes de référence
Ce sont donc des électrodes de potentiel constant . Le couple rédox présent autour du métal conducteur a un potentiel de Nernst qui doit être très peu variable, quel-que-soit le milieu dans lequel l'électrode plonge .
Les couples privilégiés :
solide liq pur dissout
"calomel"
Pour que le potentiel de ce couple reste constant , il suffit donc de s'assurer que [Cl-] reste constant : c'est l'équilibre de dissolution de KCl , très avancé , à saturation de KCl solide, qui maintient [Cl-] à une valeur très élevée, peu sensible à des variations relatives.
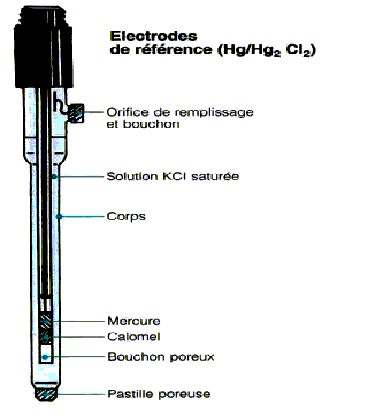
Cette électrode s'appelle
L'électrode au calomel à KCl saturé.
Comme toute électrode de référence , elle possède un orifice de remplissage qui permet de renouveler le solide KCl qui se dissout qu fil des utilisations , ou du temps, par trempage en solution aqueuse. Des cristaux de KCl sont normalement visibles, posés sur la pastille poreuse.
Cette pastille poreuse joue le rôle de pont ionique entre le corps de l'électrode ( compartiment réf) et le bécher d'étude (compartiment mesure ) , entre lesquel le potentiel est mesuré.
En présence d'une solution saturée de KCl :
Eréf(calomel) = 0,245 V
- Hg2SO4 / Hg : Hg2SO4 + 2 e- = Hg + SO42- EN = E° - 0,03 log [SO42-]
sulfate mercureux
Elle est fabriquée en présence de sulfate de potassium dissous à saturation . Elle a exactement la même allure que l'électrode ci-dessus, le sulfate mercureux remplaçant le calomel, visuellement identiques. C'est l' électrode au sulfate mercureux.
En présence de sulfate de potassium dissous à saturation :
E°réf(sulfate mercureux) = 0,615 V
La seule différence entre ces électrodes est donc le contre ion sulfate vs les ions chlorures. Certains milieux sont incompatibles avec les chlorures : exemple typique, les ions Ag+ : ils précipitent sous forme AgCl, et ce , DANS la pastille poreuse...qui en perd sa porosité, donc plus de pont...l'électrode est définitivement perdue !!!
Donc en présence d'ions Ag+ , on utilise IMPERATIVEMENT une électrode au sulfate mercureux en référence.
- AgCl / Ag : AgCl + e- = Ag + Cl- EN = E° - 0,06 log [Cl-]
chlorure d'argent
Cette électrode est utilisée comme électrode de référence interne dans le cas d'électrodes de pH combinées...
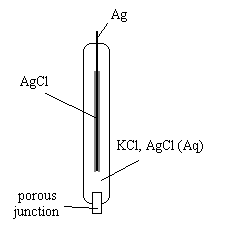 C'est l' électrode de référence AgCl/Ag
C'est l' électrode de référence AgCl/AgElle est fabriquée en présence de KCl saturée et alors : Eréf(AgCl/Ag) = 0,222 V
Elle est fabriquée en tube ultra fin pour être à l'intérieur d'une électrode de verre et donc donner une électrode de verre combinée, en présence d'un gel et ou de paroi l'isolant d'ions gênants pour Ag+ .
Elle est parfois aussi utilisée seule en indépendante...
2- Les électrodes de mesure
C'est une électrode sensible à un différentiel de concentration d'ions H+, de part et d'autre d'une membrane de verre ultra fine . De fait , elle fournit un potentiel caractéristique de la concentration en H+ du milieu dans lequel elle est plongée, bref, elle mesure le pH .
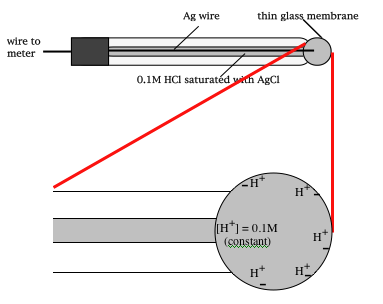
La très fine membrane de verre est chargée négativement de part et d'autre de son épaisseur, charge normalement compensée par les ions Na+. En présence de H+, ces charges sont partiellement compensées par H+.
A l'intérieur : Na+surf + H+sol int = Na+sol int + H+surf
Comme [H+] = cste en interne, l'équilibre est atteint à l'intérieur.
(surf = surface verre sol int = solution interne)
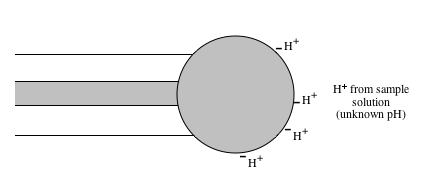
A l'extérieur , les charges - de la surface sont soumises au même équilibre, mais avec une quantité de H+ différente dans le milieu externe. La position de l'équilibre précédent, à l'extérieur est différente.
Le différentiel de bilan de part et d'autre crée une ddp de part et d'autre de la membrane et donc
E = f(pH)
Une mesure de pH devrait alors se faire selon le schéma suivant :
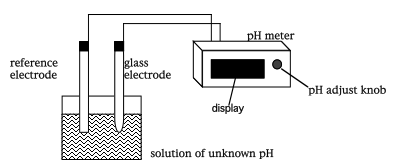
En réalité , de nos jours on n'utilise quasiment plus que des électrodes de verre combinées ou électrodes de pH combinées, contenant l'électrode de référence interne :

Electrode de pH combinée
La zone rose correspond à la zone sensible au pH et donc à l'électrode de verre proprement dite, alors que la zone blanche correspond à l'électrode de référence interne AgCl / Ag . C'est un câble coaxial qui est branché en haut de l'électrode. Les deux câbles sont souvent séparées à l'entrée du voltmètre.
On note le petit bouchon en haut de l'électrode destiné à fermer l'orifice de remplissage de KCl, qui permet de régénérer l'électrode de référence (point commun à toutes les électrodes de référence
- L'électrode de platine : dosage redox
Par contre, pour suivre par potentiométrie le dosage de Ag+ par précipitation par Cl- par exemple, elle n'est d'aucune utilité puisque aucun couple n'est défini en solution. Un tel montage donnerait un potentiel parfaitement aléatoire au grè du moindre souffle d'air au dessus du bécher (couple O2 / H2O ! par exemple ).
- Les autres électrodes métalliques : dosages par pptation ou complexation
Couple en solution Mn+ / M : EN = E° + (0,06/n ) log [Mn+] variable en fonction de [Mn+] ...
Donc, pour résumer :
Dosage de Fe2+ par OH- : précipitation : électrode de fer
Dosage de Fe2+ par MnO4- : redox : électrode de platine