Une orbitale atomique (OA) est :
- Une fonction mathématique φ , ( solution de l'équation, mythique pour l'instant , de Shrodinger H(φ) = E.φ ) , porteuse de renseignements sur un électron qu'elle caractérise .
- Caractérisée par un triplet unique de 3 nombres quantiques n ( nombre quantique principal ) , l (nombre quantique secondaire) et m (nombre quantique magnétique) , tels que
0 ≤ l ≤ n-1
et -l ≤
m ≤ l
- Associée au niveau d'énergie quantifiée E, ( Le E qui est dans l'equation de Shrodinger ) qui ne dépend que de n et l pour un atome polyélectronique
- Notée selon un code qui ne dépend que de n et l , et donc du niveau d'énergie associé
l=0 => ns unique
au niveau n
l=1 => np au nombre de 3 au niveau n
l=2 => nd au nombre de 5 au niveau n
l=3 => nf au nombre de 7 au niveau n
l=1 => np au nombre de 3 au niveau n
l=2 => nd au nombre de 5 au niveau n
l=3 => nf au nombre de 7 au niveau n
Donc l'OA de triplet ( n=2, l=1, m=-1 ) s'appelle 2p mais l'OA de triplet ( ( n=2, l=1, m=0 ) s'appelle aussi 2p, au même niveau d'énergie.
L'OA de triplet ( n=3, l=2, m=... ) s'appelle 3d
- Descriptive au maximum de 2 électrons de nombre de spin différents : s qui caractérise l'électron ne peut prendre que 2 valeurs +1/2 ou -1/2
- Porteuse de renseignement sur le volume de probabilité de
présence de l'électron selon le calcul de
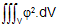 =0,9 avec V inconnu .
=0,9 avec V inconnu .
Les allures suivantes sont à connaitre : ( les indices x, y ou z ou xy ou ... sont relatifs aux directions associées de l'espace orthonormé (O, x,y,z )
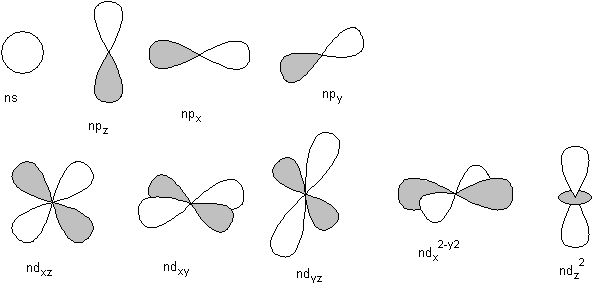
Les parties grisées, par opposition aux parties blanches, signifient que la fonction φ dont on a calculé le carré dans cette partie de l'espace ont un signe opposé dans une lobe ou dan l'autre. La probabilité de présence qui en résulte est bien sûr positive et symétrique .Les positions des parties grisées / blanches sont purement aléatoires dans cette présentation (elles peuvent seulemnt être inversées comme vous le souhaitez ) .
- (Une OA est ) aussi, par abus de langage , le volume de probabilité de présence = 0,9 dans lequel on a donc 90% de chance de trouver l'électron représenté par L'OA ( fonction mathématique ) . On pourra donc dire : l'électron DANS l'OA 2s ... ou les électrons dans les OA 3p.
II- CONFIGURATION ELECTRONIQUE
La configuration électronique est la répartition des électrons dans les différentes OA .
On la trouve par application de différentes règles :
Règle de pauli : Il ne peut exister dans un atome deux électrons qui possèdent simultanément les mêmes nombres quantiques n, l, m et s.
Règle de Klechkowski : On classe les OA par ordre croissant d'énergie : ordre croissant de n+l, et pour n+l identiques, alors par ordre croissant de n
Règle de remplissage : On obtient l'état fondamental de plus basse énergie en remplissant les OA par ordre croissant d'énergie ( voir Règle de Klechkowski)
Règle de Hundt : Lorsque les électrons sont dans des OA de même énergie ( dites ...dégénérées ) , la configuration la plus stable est celle pour laquelle le nombre de spin TOTAL ( la somme ) est maximal. ( c'est-à-dire on n'apparie les électrons que quand on ne peut plus faire autrement )
On obtient donc l'odre de remplissage suivant :
n+l = 1 : 1s
n+l = 2 : 2s
n+l = 3 : 2p 3s
n+l = 4 : 3p 4s
n+l = 5 : 3d 4p 5s
n+l = 6 : 4d 5p 6s
n+l = 7 : 4f 5d 6p 7s .....etc.... tout moyen mnémotechnique de votre connaissance étant plus que recommandé !
Rappel : il existe 3 OA de même nom de type np dégénérées ( c'est à dire au même niveau d'énergie) , et 5 OA de même nom de type nd dégénérées ...de sorte que l'on peut mettre
- 2 électrons au maximum dans ns
- 6 électrons au maximum dans np
- 10 électrons au maximum dans nd ...
Exemple : Fe (26) : 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Les électrons de valence sont les électrons de le couche de plus grand n + les électrons de la dernière sous-couche non pleine. Les autres sont les électrons de coeur : ils ne particpent pas à la réactivité chimique de l'atome
Exemple : les électrons de valence du Fer sont les électrons : 4s2 3d6 (8 électrons de valence )
Certaines configurations électroniques de valence sont plus stables et conduisent à des anomalies de remplissage / règles énoncées: il s'agit de configurations présentant dans leur couche de valence une sous-couche pleine ou demi-pleine ( sauf s )
Conséquences :
- Cr(24) : 1s2 2s2 2p6 3s2 3p6 4s2 3d4 est en réalité 1s2 2s2 2p6 3s2 3p6 4s1 3d5
- Cu(29) : 1s2 2s2 2p6 3s2 3p6 4s2 3d9 est en réalité 1s2 2s2 2p6 3s2 3p6 4s1 3d10
- O ( 2s2 2p4 ) -> O+ ( 2s2 2p3 ) est plus facile que prévu (crée une configuration plus stable ) , mais
- N ( 2s2 2p3 ) -> N+ ( 2s2 2p2 ) est plus difficile que prévu ( détruit une configuration plus stable ) .... etc...
Configuration électronique d'un ion négatif : partir de la configuration électronique de l'atome neutre et rajouter autant d'électrons que nécessaire selon les mêmes règles de remplissage.
Configuration électronique d'un ion positif :
Pour la trouver , il faut :
- partir de la configuration électronique de l'atome neutre .
- Enlever prioritairement les électrons de + grand n,
- puis si nécessaire les électrons de la sous couche de n inférieur remplie en dernier.
Exemple : Fe2+ : on part du fer métal : la couche de plus grand n : n=4 : on enlève les 2 électrons de la 4s soit : Fe2+ : 1s2 2s2 2p6 3s2 3p6 4s0 3d6
Fe3+ : on part du fer métal : la couche de plus grand n : n=4 : on enlève les 2 électrons de la 4s puis 1 électron dans le 3d :
Fe3+ : 1s2 2s2 2p6 3s2 3p6 4s0 3d5
Des exercices relatifs à ces notions pourront être trouvés ICI .