Intro
I- Les intéractions de Van der Waals
1/ Description physique
2/ Manifestations expérimentales
II- Les liaisons hydrogène
1/ Description physico chimique
2/ Conséquences observables
Conclusion
En version plus
développée...
Intro :
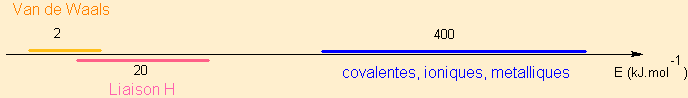
Placer sur un axe en énergie les ordres de grandeur des différents types de liaison pour justifier "faible énergie" :
I- Les intéractions de Van der Waals
1/ Description physique
L' intéraction de Van der Waals est une intéraction d'attraction entre molécules à couches complètes (exclut tous les dons de doublets dans des lacunes électroniques)
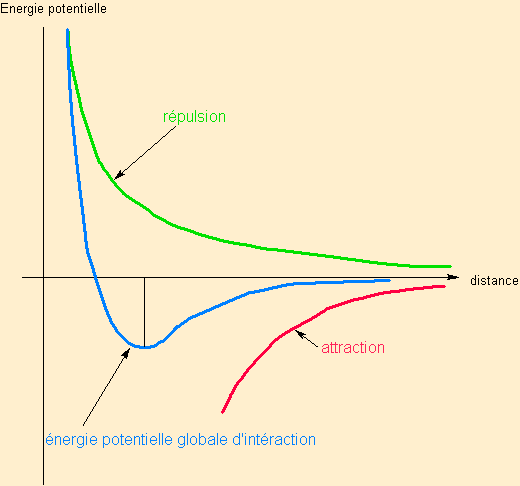
Quel que soit le type d'intéraction ( dipôle / dipôle , dipôle / dipôle induit , dipôle induit / dipôle induit qui s'appelle intéraction de London ) , on montre que le potentiel moyen d'attraction est de la forme +C/r6. Le signe + est caractéristique de l'effet d'attraction.
2/ Manifestations expérimentales
Responsables de la cohésion des cristaux moléculaires / I2 , CO2
Responsables de l'adhésion des polymères utilisés comme colles
Responsables de la solubilisation de molécules apolaires dans des solvants apolaires, ou légèrement polaires
II- Les liaisons hydrogène
1/ Description physico chimique
Est en réalité une intéraction de Van der Waals, mais beaucoup plus forte, de telle sorte qu'elle écrase toutes les autres si elle existe => traitée à part.
Attraction électrostatique qui s'établit entre un H déficitaire en électron dans la liaison covalente dans laquelle il est engagé , et un atome électronégatif, excédentaire en électrons, porteur d'un doublet libre, en général, O, N, ou un halogène.
D'autant plus forte qu'elle est courte ( on parle même d'une force de contact ) et nulle au delà d'une certaine limite en distance. Longueur de la "liaison H" de l'ordre de longueur d'une liaison covalente : 200pm.
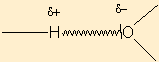
2/ Conséquences observables
IR des fonctions alcools, différence dilué, concentré
RMN des fonctions alcool ( ne couple pas)
Conductivité exceptionnelle des sions H3O+ et OH- (faire le schéma mécanistique du mouvement électronique avec le rôle de la liaison H )
Températures d'ébullitions élevées ( Comparer C2H5OH et CH3-O-CH3 , de même masse molaire )
Cohésion de la glace ...( dessiner le cristal type diamant ...selon le temps...)
Dimérisation des acides carboxyliques
Stabilisation des énols issus de dicétones ( énol avec cycle à 6 centres fermé par une liaison H)
Cristallinité partielle de certains polyméres assurée par liaisons régulières entres chaînes par liaisons H
Sturucture de l'ADN, d'enzymes, importance dans la conception de médicaments
Fixation de colorants sur fibres de coton ou de laine
Conclusion
Si la liaison H existe, masque toutes les autres intéractions de Van der Waals
Intéractions attractives compensées par des intéractions répulsives en -C'/r12 d'où le schéma aboutissant à une distance d'équilibre qui permet de définir des liaisons de faible énergie (distinguer la notion d'intéraction de la notion de liaison qui impose un minimum d'énergie :