Intro
I- La nature de la soude carbonatée
1/ Réactions
2/ Bilan chimique
II- Dosage
1/ Les réactions de dosage
2/ Allure de la courbe de dosage
3/ Exploitation
Conclusion
En version plus
développée...
Intro :
La soude carbonatée s'obtient par dissolution du gaz acide CO2 dans une solution aqueuse de NaOH.
Données : valeurs des pKa : 6,4 et 10,3 ⇒ axe de prédominance
les constantes d'équilibre sont supposées connues.
I- La nature de la soude carbonatée
1/ Réactions
Le dioxyde de carbone se dissout dans l'eau en donnant H2CO3, qui est l'espèce acide qui sera considérée.
Hypothèse : la soude reste en excès par rapport au dioxyde de carbone dissous
RP1 : CO2 gaz + H2O = H2CO3 dissout
RP2 : H2CO3 + OH- = HCO3- + H2O totale et H2CO3 en défaut
RP3 : HCO3- + OH- = CO32- + H2O totale et HCO3- en défaut
RP4 : OH- + H2O = idem
2/ Bilans chimiques
Soit Co la concentration initiale en soude et Vo la volume total de la solution carbonatée . Soit n le nombre de moles de CO2 gaz qui se dissolvent sous forme H2CO3 dissout
- 1° cas, la carbonatation est accidentelle, il n'y a pas d'équilibre avec CO2 gaz présent dans l'air.
n 0
0 n
RP2 : H2CO3 + OH- = HCO3- + H2O
n CoVo 0
0 CoVo-n n
RP3 : HCO3- + OH- = CO32- + H2O
n CoVo-n 0
0 CoVo-2n n
La RP suivante ne changeant pas la concentration en OH- , on pourrait calculer les concentrations résiduelles en HCO3- et en H2CO3 par les LAM .
[H+] = Ke.Vo / (CoVo-2n) [ CO32- ] = n/Vo [ HCO3- ] = [H+]. [ CO32- ] / Ka2 [ H2CO3 ] = [H+]. [ HCO3- ] / Ka1
n sera déterminé par dosage
- 2° cas : la carbonatation s'est produite par l'équilibre de dissolution de CO2 gaz , maintenu à P constante
P 0
P n
RP2 : H2CO3 + OH- = HCO3- + H2O
n CoVo 0
n CoVo-x-y x-y
RP3 : HCO3- + OH- = CO32- + H2O
x CoVo-x 0
x-y CoVo-x-y y
[H2CO3 dissout ] = K.P = n/Vo Ka1 et Ka2 donnent alors un système de deux équations à deux inconnues par les LAM, mais pas si facile à résoudre .... D'après l'hypothèse de départ (OH- en excès) , on sait que y >n ...et il apparait délicat de négliger (x+y) devant CoVo.
Remarque : si la constante de dissolution de CO2 gaz n'est pas donnée, on peut avantageusement se limiter au 1° cas, et mentionner ce deuxième cas en conclusion...
II- Dosage
1/ Les réactions de dosage
On travaille dans le cas de carbonatation accidentelle, car l'autre cas ne nécessite pas de dosage (tout est connu !)
La soude carbonatée contient donc majoritairement deux bases : OH- et CO32- , que l'on peut doser par un acide fort. Les réactions de dosage sont :
OH- + H+ → H2O K1=1014
CO32- + H+ → HCO3- K2 = 1010,3
HCO3- + H+ → H2CO3 K3 = 106,4
H+ est ensuite ajouté en excès.
2/ Allure de la courbe de dosage
On attendrait 3 saut de pH MAIS , comme un tracé de courbe de dosage se fait à l'aide d'une électrode de pH limitée par la valeur plafond 12, et comme CO32- est une base trop forte, OH- et CO32- sont dosées simultanément.
On observe donc un premier saut lisible de pH à la fin du dosage simultané de OH- et CO32- , puis un deuxième saut à la fin du dosage de HCO3- , obtenu par addition d'un excès d'acide.
La courbe ci-dessous donne la SIMULATION de la courbe théorique de dosage (PH initial de 13 qui ne serait pas fourni par une mesure réelle) . Malgré ce pH initial de 13 , vous constatez que le premier saut (autour de 20 ml) n'est quand même pas exploitable...
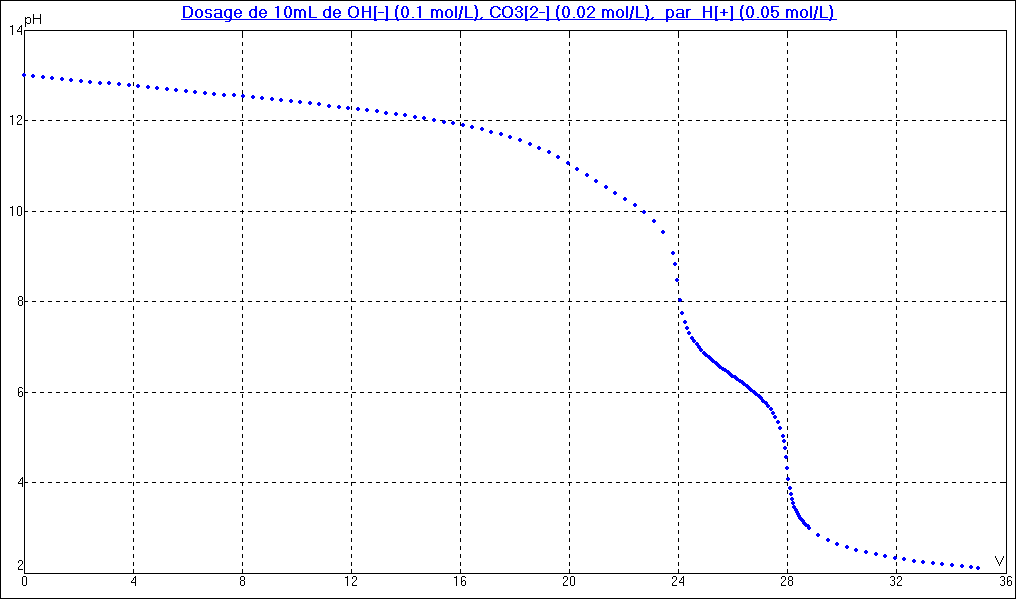
Vous devez en connaitre l'allure , avec des précisions sur les points particuliers
Le pH à la première équivalence est de l'ordre de 1/2 ( PKa1 + pKa2) soit 8 . A la 1/2 équivalence, le pH est de l'ordre de pKa1 soit 6,4 . Le pH final est de l'ordre légèrement supérieur à -log (0,05) (par dilution) .
3/ Exploitation
Soit v1 le premier volume équivalent : il correspond au dosage de OH- et CO32- :
CH+.v1 = (CoVo-2n) + n soit CH+.v1 = CoVo-n
Soit v2 le deuxième volume équivalent : v2-v1 correspond au dosage de HCO3- :
CH+.(v2 - v1 )= n
Rappel : la soude carbonatée accidentellement contient CoVo - 2 n moles de OH-
Sa concentration résiduelle est donc : (CoVo - 2 n ) / Vo en OH- et n/Vo en CO32- .
Conclusion
Il faut donc conserver les solutions de soude à l'abri de l'air pour les protéger de la carbonatation. Bien que 2n moles de soude disparaissent par dissolution de n moles de dioxyde de carbone, il se forme n moles de carbonate, qui se comporte comme une base forte dans le cas d'un dosage d'acide fort. la perte en potentiel dosant d'un acide fort n'est donc que de n...
Pour un acide faible....moins efficace !