Intro
I- Définitions
1/ Mono et polyacides dans l'eau
2/ Force des acides
3/ Diagrammes de prédominance
II- Effet du milieu sur la force des acides
1/ Constante d'acidité apparente
2/Effets de la dilution
Conclusion
En version
plus
développée...
Intro : un peu plus longue que d'ordinaire , être clair sur les réactions de référence et la thermo :
Une constante d'acidité est une constante d'équilibre particulière : relative à l'équilibre de l'action d'un acide sur l'eau, prise comme base
Un acide au sens de Lewis est une espèce susceptible de perdre un proton dans l'eau.
Définir une constante d'équilibre dans le cas général ( exp(-ΔrG°(T)/RT ) , valeur thermodynamique caractéristique de l'écriture d'une réaction, listée dans les tables.
Les constantes d'équilibre apportent par leur valeur des renseignements sur l'état d'équilibre (réalisé, chimiquement ) grâce à la LAM.
I- Définitions
1/ Mono et polyacides dans l'eau
Soit un acide HA : son action sur l'eau , solvant : HA + H2O = A- + H3O+ On définit la constante d'acidité Ka de l'acide HA , dans le couple HA/A- , par
Ka(T) = exp ( -ΔrG°(T)/RT )
A- est la base conjuguée de l'acide HA
Conséquence : On peut trouver dans les tables toutes les valeurs de -ΔrG°(T) et donc calculer toutes les valeurs de Ka . Ces valeurs sont exprimées sous la forme -log Ka = pKa
Exemple : L'acide CH3COOH est un acide de pKa = 4,6 , soit Ka = 10-4,6 constante relative à CH3COOH + H2O = CH3COO- + H3O+
Certaines espèces peuvent libérer plusieurs protons : ce sont des polyacides, pour lesquelles on peut définir plusieurs constantes d'acidité :
Exemple : H3PO4 + H2O = H2PO4- + H3O+ mais H2PO4- est aussi un acide selon l'équilibre
2/ Force des acides
Exemples de 3 acides de pKa différents :
- H3PO4 ( pKa = 2 )
- CH3COOH ( pKa = 4.8 )
- HPO42- (pKa = 12,3)
En déduire l'échelle des pKa : des acides infiniment forts de pKa <0 ( H2SO4 ou HNO3 ) aux acides infiniment faibles de pKa >14 ( alcoolate , amindure)
Parler du nivellement de la force des acides ou des bases par l'eau
3/ Diagrammes de prédominance
Exprimer la LAM , en déduire la limite de prédominance entre les 2 formes acide et base à pH = pHa , et la limite à 90 / 10 % à pKa+1 et pKa-1
Exemple du diagramme de prédominance pour un acide aminé par exemple :
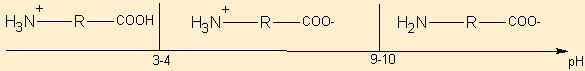
Utilisation des diagrammes de prédominances ou de la comparaison des pKa pour deviner l'avancement d'une réaction à l'équilibre :
On pourra présenter un résumé de ce que l'on lit ICI
Liaison avec le § suivant . Il faut toutefois se garder de tout prévoir avec les valeurs numériques des constantes d'équilibre :
II- Effet du milieu sur la force des acides
1/ Constante d'acidité apparente
Prendre l'exemple de votre TP : HBO2 + M = BO2M- + H+ K'a = [H+ ][ BO2M- ] / [HBO2 ][M]
La valeur de K'a ne permet pas de conclure car n'a pas la forme mathématique habituelle
Mais K'a x [M] = [H+ ][ BO2M- ] / [HBO2 ] peut être constant en excès fixé de M => K'a x [M] = constante apparente qui pourra renseigner au même titre qu'un Ka "ordinaire"...
2/Effets de la dilution
Reprendre le calcul du taus de dissociation de l'acide acétique pour des concentrations différentes ( 0,1 ; 0,001 ; 0,00001 ) et montrer que le taux de dissociation à faible dilution est quasi de 100% : devient un acide fort.
=> le raisonnement sur la valeur de Ka pour mesurer la force des acides est valable pour des valeurs "ordinaires" de concentration.
Conclusion
Outil très puissant pour prévoir la nature et l'avancement des réactions A/B . Indispensables à connaitre pour tout calcul relatif à des acides ou des bases en solution aqueuse .
On détermine ces constantes expérimentalement , par conductivité absolue, par mesure du pH aux demi équivalences, par cryoscopie...