Intro
I- Définitions
1/ Les différents types de réaction
2/ Définition de la vitesse
II- Propriété des vitesses
1/ Etapes élémentaires
2/ Cas des Intermédiaires réactionnels INSTABLES
3/ Réactions élémentaires opposées, en équilibre
4/ Réactions globales
III- Etudes cinétiques pour validation d'un mécanisme ou suivi de synthèse
1/ Protocoles expérimentaux simplifiants les lois de vitesse
2/ Résolution des équations différentielles
3/ Vérification expérimentale
4/ Mesure du temps comme mesure d'avancement
Conclusion
En version
plus
développée...
Intro :
L'étude des réactions comprend deux grands domaines : la cinétique et la thermodynamique, domaines qui peuvent se rejoindre parfois.
Les exemples seront choisis relativement à la polymérisation radicalaire, entre autres .
I- Définitions
1/ Les différents types de réactions
- Les réactions globales : 1/2A + n M --> I-(M)n (dans le cadre d'une terminaison par dismutation ) qui décrivent uniquement l'état initial et l'état final , en tentant de mentionner au mieux la conservation de la matière : vision macroscopique
- Les étapes élémentaires qui traduisent la rencontre entre les différentes espèces, produisant des espèces intermédiaires , plus ou moins instables, non présentes à l'état final, mais observables ( minimum d'énergie) . C'est au cours de choix entre les réactifs que se produisent les transformation donnant les produits : vision microscopique .
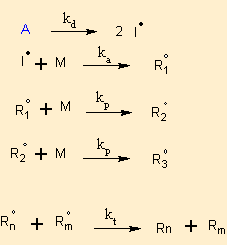 |
(d) étape de dissociation (d) + (a) constitue l'initiation (a) étape d'amorçage (p1) étape 1 de propagation (p2) étape 2 de propagation (t) étape de terminaison |
2/ Définition de la vitesse
Quelle que soit le type réactionnel , la vitesse est définie par :
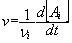 , vitesse
spécifique, à V = cte
, vitesse
spécifique, à V = ctePar exemple , pour la réaction de polymérisation , bilan :
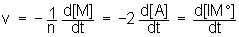 puis définir la vitesse de disparition de M ( -d[M] / dt ) , puis la
vitesse de chaque étape élémentaire , par exemple
puis définir la vitesse de disparition de M ( -d[M] / dt ) , puis la
vitesse de chaque étape élémentaire , par exemple 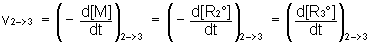 ( bien
remarquer les parenthèses et relatif à la seule étape mentionné)
( bien
remarquer les parenthèses et relatif à la seule étape mentionné) => montrer comment le mécanisme permet de retrouver la vitesse de disparition de M
On peut aussi travailler sur l'étape de dissociation du radical...au choix...
Arbitrairement , la vitesse de polymérsation est définie comme la vitesse de disparition du monomère , différente de la vitesse du bilan réactionnel.
II- Propriété des vitesses
1/ Etapes élémentaires
Chaque étape élémentaire voit sa vitesse s'écrire :
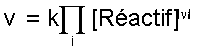 .
.Définir k (loi de Van't Hoff cinétique ), énergie d'activation , ordre partiel, ordre global ( rappeler <3 car sinon pas de rencontre ) .
Rappeler schéma ( E / CR ) pour placer Ea =barrière d'énergie , niveau de l'intermédiaire.
Toute étape élémentaire voit sa vitesse augmenter avec T.
Donner un exemple d'expression à partir du mécanisme de polymérisation : va = ka [I°][M]
2/ Cas des Intermédiaires réactionnels INSTABLES
On appelle IR INSTABLE un intermédiaire réactionnel fabriqué lentement et consommé rapidement : on montre alors que d[IRinstable] / dt = 0
=> Obtention d'une équation permettant d'exprimer la concentration en IR instable en fonction de concentration d'espèces plus stables :
Application à I° : ...=> 2kd[A] =ka [I°][M] Application à la somme des [Ri°] => va = 2 Vt
3/ Réactions élémentaires opposées, en équilibre
équilibre macroscopique signifie vitesses des réactions opposées égales => K=ki / k-i
cinétique et thermo se rejoignent là...
4/ Réactions globales
Les expressions ( ou proproétés) des vitesses des réactions globales se déterminent à partir de mécanismes posés en hypothèses, ou se posent directement en hypothèse d'après des résultats expériementaux, ou justifiées a postériori par des résultats expérimentaux.
Toutes les réactions globales n'ont pas d'ordre, mais il arrive que certaines aient un ordre...
Prendre en exemple la polymérisation radicalaire : trouver vp sans rien négliger et montrer qu'elle n'a pas d'ordre. Négliger va et montrer qu'elle est d'ordre 1/2 en [A] et 1 en [M]
Si ordre : v= k [réactif1]α1 [réactif2]α2 [catalyseur]α3 avec définition ordre partiel et global....Très exceptionnellement , il peut arriver que Ea = CL des Ea des étapes élémentaires soit négatif...
III- Etudes cinétiques pour validation d'un mécanisme ou suivi de synthèse
1/ Protocoles expérimentaux simplifiants les lois de vitesse
Soit une réaction globale avec un ordre supposé v = ( 1/νi ) d[i] / dt = k [i]α1[j]α2 est une équation différentielle facile à intégrer si et seulement si :
- i et j sont en quantité stoechiométrique
- j ou i en excès devant l'autre...
2/ Résolution des équations différentielles
Poser les équation différentielles pour ordre 0,1,2 et donner directement les résultats d'intégration sous la forme f(x) = kt (linéaire) .
Donner aussi Directement les temps de 1/2 réaction .
3/ Vérification expérimentale
Enoncer des moyens pour suivre des cinnétiques : mesures de Ptotal , absorbance, conductivité, pH, dosages d'échantillons prélevés, etc...
On relie x à la variable expérimentale => loi cinétique en f(variable) = kt
Tracé , analyse pour infirmer ou confirmer l'hypothèse faite en terme de loi de vitesse.
4/ Mesure du temps comme mesure d'avancement
On peut aussi exprimer x= f(t) à partir de la loi cinétique et donc si tous les paramètres des réactions sont connus, mettre en place un contrôle de l'avancement de la réaction par le temps...
Application : synthèse des polymères : la mesure du temps contrôle l'avancement et donc le DPn du polymères ( contrôles multiples mis en place en réalité )
Conclusion
Les études cinétiques peuvent être faites en chimie "théorique" pour rechercher le mécanisme d'une réaction, mais aussi en chimie industrielle pour contrôler l'avancement des réactions .