Ce rappel de cours sera une source pour les questions de cours d'oral " modèle de Lewis" et "Méthode VSEPR"
I- Le modèle de Lewis
Principes de base et mode de représentation
On sait que les atomes les plus stables chimiquement sont les gaz rares. On attribue cette stabilité à la couche de valence pleine de ces atomes.
Lewis considère alors que si des atomes établissent une structure moléculaire stable, c'est que dans la molécule constituée, chaque atome a acquis la configuration de valence du gaz rare qui le suit dans la classification, grâce à une mise en commun d'électrons de la couche de valence des atomes liés.
C'est la mise en commun d'électrons qui constitue la liaison entre les atomes. Deux électrons mis en commun entre deux atomes constituent une liaison. Ils seront représentés sous forme d'un tiret entre les deux atomes partageurs. On appellera ce doublet un doublet de liaison ou doublet liant ou doublet lié.
Si les atomes présentent sur leur couche de valence des électrons non mis en commun, ils seront représentés par paire, par un tiret, localisé sur l'atome porteur. On appellera cette paire d'électrons un doublet libre ou doublet non liant.
Un électron non "apparié" apparaitra par un point ° .
Vous aurez remarqué que tout ce modèle est relatif aux électrons de valence
Soit une entité chimique , neutre ou chargée , constituée d'un certain nombre d'atomes.
1- Compter le nombre d'électrons de valence de chaque atome neutre .
2- Sommer sur l'ensemble de la molécule l'ensemble des électrons de valence : y ajouter ( respectivement retrancher) autant d'électrons que de charges négatives ( positives ) si la molécule est chargée négativement ( positivement)
On obtient donc le nombre N d'électrons de valence à mettre en commun.
3- Si N est pair , on dessinera N/2 doublets autour des atomes dans la molécule
Si N est impair , on dessinera [( N-1 ) / 2 ] doublets + 1 électrons célibataire ° autour des atomes dans la molécule.
Règles de mise en commun :
- H cherche à s'entourer de 2 électrons ( un doublet ) . C'est le maximum.
- Les éléments de la deuxième période cherchent à s'entourer de 8 électrons ( 4 doublets correspondant aux 4 OA de valence pleines ) . C'est le maximum possible . Ceci constitue la règle de l'octet.
- Les éléments de la troisième période cherchent à s'entourer de 8 électrons ( 4 doublets correspondant aux 4 OA de valence pleines ) . Toutefois, ils peuvent accepter plus de doublets autour ( accueillis dans les OA 4s et 3d vides très proches en énergie ) . Ils peuvent donc déroger à la règle de l'octet.
- Si le nombre de 4 doublets minimum n'est pas atteint , cela doit obligatoirement être mentionné par le dessin d'un petit rectangle par doublet manquant, signifiant une OA de valence vide ou lacune électronique.
- Les éléments de la 4° prériode cherchent à s'entourer de 18 électrons ( 9 doublets correspondant aux 9 OA de valence 4s, 3d, 4p )
4- Placer tous les doublets autour des différents atomes en respectant les règles énoncées ci-dessus . Vérifier le décompte des doublets autour de chaque atome et mentionner les lacunes électroniques éventuelles. Dans le cas de molécules complexes, l'enchainement des atomes doit être fourni par ailleurs.
5- Chercher les charges éventuelles :
Pour chaque atome, vous connaissez le nombre d'électrons de valence correspondant à la neutralité ( calculé au 1- ) . Soit n ce nombre.
Dans la molécule, cet atome est entouré d'un certain nombre d'électrons : chaque doublet de liaison apporte 1 électron à l'atome, chaque doublet libre compte pour 2 électrons qui lui appartiennent en propre , un électron célibataire compte pour un électron .
- Si ce décompte conduit à n électrons, l'atome est neutre.
- Si ce décompte conduit à n+x électrons, cet atome est chargé x-
- Si ce décompte conduit à n-x électrons, cet atome est chargé x+ logique ...
6- Chercher les éventuelles formes mésomères:
La forme mésomère principale doit :
- priorité 1 : faire respecter la règle de l'octet à tous les atomes, ou au nombre maximum d'atomes .
- priorité 2 : minimiser les charges portées par les différents atomes ( sans perdre de respect d'octet ) , placer les charges selon l'électronégativité comparée des atomes .
- priorité 3 : écrire la molécule la plus symétrique possible ( à octet max et charge identique )
Si le respect de toutes ces priorités conduit à plusieurs écritures, alors elles doivent toutes être mentionnées.
D'autres formes mésomères peuvent être écrites pour mettre en valeur certaines réactivités, mais ne représenteront pas la forme stable de la molécule.
II- LA MéTHODE VSEPR
Principes et Notions de géométrie
Dans ce modèle, la disposition dans l'espace des doublets mentionnés dans le modèle de Lewis (préalable) , est imposée par la répulsion entre les nuages électroniques de valence autour de chaque atome. On raisonne atome par atome , pour trouver la disposition de ces nuages autour de lui.
Les nuages de charge négative, exercent une répulsion entre eux que la nature chercherait à minimiser ( toujours à la recherche de l'état le plus stable ...le nirvana moléculaire quoi ... )
Or pour minimiser une répulsion...il faut éloigner le plus possible les éléments en répulsion, sauf que tous les nuages sont "attachés" par une extrémité au noyau de l'atome regardé
Conséquence : la disposition adoptée par les nuages dans l'espace correspond à des figures géométriques prévisibles, autour du noyau, disposition qui dépend seulement du nombre de nuages (liants ou non-liants, peu importe ).
On remarquera que le mot nuage a été employé et non doublet, car des liaisons multiples existent : une double liaison, relative à deux doublets, ne définit que une seule direction de liaison ou un seul nuage, de même qu'une triple liaison...
On peut "deviner " ces figures : Soit A l'atome autour duquel sont disposés les nuages ( liants ou non liants) :
| 2 nuages | 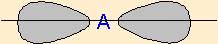 | Le long d'une ligne, les nuages électroniques sont séparés par l'angle maximium : 180° |
| 3 nuages | 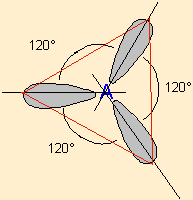 | Les nuages électroniques sont séparés par un angle de 120° dans un même plan . Les extrémités de ces nuages pointent vers les sommets d'un triangle équilatéral au centre duquel se trouve l'atome A . |
| 4 nuages | 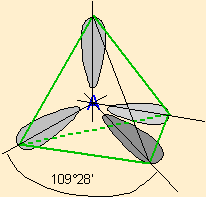 | Les nuages électroniques sont séparés par un angle de 109°28' , car ils pointent vers les sommets d'un tétraèdre régulier, au centre duquel se trouve A |
| 5 nuages | 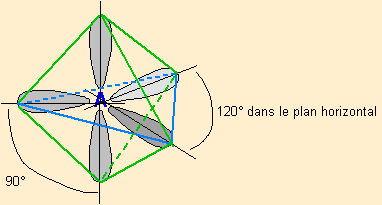 | Il n'existe pas de figure géométrique de symétrie d'ordre 5 ( renseignement fourni par d'éminents matheux...) donc tous les angles ne sont pas identiques : 3 nuages sont séparés par un angle de 120° vers les sommets d'un triangle équilatéral ( dans le plan horizontal ici ) Les 2 autres nuages pointent verticalement vers le haut et le bas, séparés d'un angle de 90° des 3 autres doublets. Les nuages pointent vers les sommets d'une bi-pyramide à base triangulaire au centre de laquelle se trouve A |
| 6 nuages | 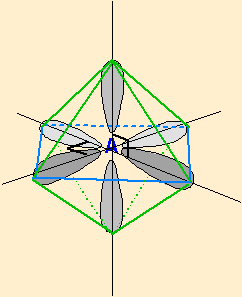 | Les nuages sont séparés par un angle de 90° . Ils pointent vers les sommets d'un octaèdre régulier, au centre duquel se trouve A |
Détermination de la géométrie d'un assemblage d'atomes
On ne peut déterminer la géométrie qu'autour d'un atome pris comme référence ( en général, l'atome le plus lié )
1- Déterminer la structure de Lewis de l'assemblage d'atomes. Compter les nuages ( N ) autour de l'atome de référence A qu'ils soient liants ou non .
2- En déduire la figure géométrique de base donnant la disposition de ces nuages dans l'espace d'après le tableau ci-dessus.
3- Distinguer alors les nuages ou doublets non-liants ( ou doublets libres) appelés E, au nombre de q , des nuages liants X au nombre de p , qui sont sur l'atome de réference A ( q + p = N ) . La molécule est alors codifiée du type AEqXp . On rappelle qu'une double ou triple liaison constitue un seul nuage.
Règle 1 : Les nuages (ou doublets) non liants ont un un effet répulsif supérieur à celui des nuages liants ( qui sont tenus par les noyaux des atomes liés )
Conséquence : la figure géométrique de base se déforme :
- les angles entre doublets non liants augmentent, pendant que , par compensation, les angles entre nuages liants diminuent .
- s'il n'y a qu'un seul doublet non liant, l'angle entre ce doublet et les nuages liants augmente légèrement, de sorte que les angles entre nuages liants diminuent aussi.
Dans la figure à 6 nuages, choisir 1 nuage comme doublet non liant ne pose pas non plus de problème, car tous sont équivalents .
Mais , dans la figure à 5 nuages ou dans la figure à 6 nuages pour le choix de plusieurs non-liants, se pose un problème de choix...
Règles 2 :
- dans la figure à 5 nuages, les doublets non liants sont choisis successivement et prioritairement dans le plan horizontal de la base trigonale de la bipyramide
- dans la figure à 6 doublets, les doublets non liants sont choisis successivement et prioritairement dans la même base carrée de l'octaèdre régulier.
4- Dessiner alors la figure géométrique de base, éventuellement déformée, après le choix des positions des doublets non liants. Marquer les angles devenus inférieurs aux valeurs de base entre doublets liants . Effacer les doublets non liants .
5- Observer la figure obtenue, formée par les atomes qui entourent A, et en déduire les caractéristiques géométriques de l'assemblage d'atomes autour de A . En utilisant le vocabulaire adéquat , nommer la géométrie de l'assemblage d'atomes autour de A .
Vocabulaire :
On rappelle que 3 points définissent un plan...il n'y a donc rien d'exceptionnel à ce qu'une molécule constituée de 3 atomes soit plane ...elles le sont toutes !!!
C'est donc une "caractéristique" totalement superflue, sans aucun intérêt...n'importe quel matheux pourrait vous le dire !
Par contre , 3 atomes alignés...çà , c'est remarquable => soit la molécule est linéaire, soit elle est coudée , auquel cas, il est intéressant de préciser l'angle intérieur du coude, ou du moins un ordre de grandeur / valeur de la figure de base...
Pour les molécules à 4 atomes : s'ils sont dans un même plan , çà c'est remarquable : la molécule sera donc dite plane , en précisant la figure qui est dessinée : on dira trigonale ( plane ) si la figure est un triangle équilatéral au centre duquel est A.Elle peut aussi être plane en T ...
etc... le tout est dans votre cours ...il n'y a pas grand chose à apprendre...les matheux ont donnés des noms connus depuis longtemps aux formes géométriques que vous rencontrerez ...Parfois le chimiste est poète ...il parlera de molécule papillon... pour les figures originales .
Les tableaux ci-dessous récapitulent tout ceci :
| base | 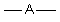 | |||
| p+q = 2 | AX2 |  | linéaire | |
| AEX |  | 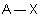 | RAS | |
| base | 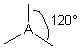 | |||
| p+q = 3 | AX3 | 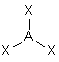 | molécule plane triangulaire ou trigonale | |
| AEX2 | 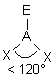 | 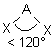 | molécule coudée angle < 120° | |
| AE2X | 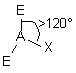 |  | RAS | |
| base | 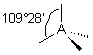 | |||
| p+q =4 | AX4 | 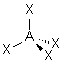 | molécule tétraédrique A au centre du tétraèdre | |
| AEX3 | 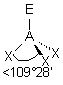 | 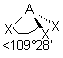 | molécule pyramidale à base triangulaire A au sommet de la pyramide | |
| AE2X2 | 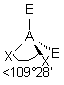 | 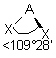 | molécule coudée angle < 109° | |
| AE3X | 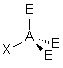 |  | RAS | |
| base | 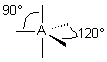 | |||
| p+q = 5 | AX5 | 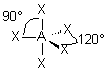 | molécule bipyramidale à base triangulaire A au centre de la bipyramide | |
| AEX4 | 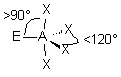 | 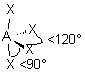 | molécule papillon | |
| AE2X3 | 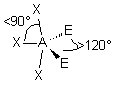 | 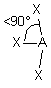 | molécule en T (légèrement déformé) | |
| AE3X2 | 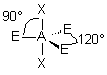 | 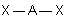 | molécule linéaire | |
| AE4X | 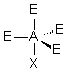 | 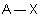 | RAS | |
| base | 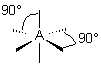 | |||
| p+q = 6 | AX6 | 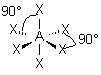 | molécule octaédrique A au centre de l'octaèdre | |
| AEX5 | 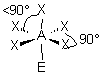 | 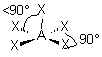 | molécule pyramidale à base carrée A au centre de la base | |
| AE2X4 | 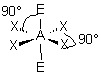 |  | molécule plan carrée A au centre du carré | |
| AE3X3 | 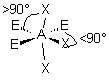 | 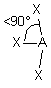 | molécule en T (légèrement déformé) | |
| AE4X2 | 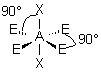 | 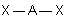 | molécule linéaire | |
| AE5X | 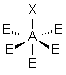 | 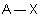 | RAS | |
YAPLUKA...vous entraîner à appliquer tout çà pour être efficace en un temps record le jour du concours devant la (les) molécules qui vous sera(ont) proposée(s)...
| CH2N2 | C : 4 e- 2H: 2x1 e- 2N: 2x5 e- Total : 16 e- => 8 doublets |
| Si2O76- | 2 Si : 2x4 e- 7O : 7x6 e- charge 6- : +6 e- Total : 56 e- => 28 doublets |
| NO2+ | N : 5 e- 2O : 2x6 e- Charge + : - 1 e- Total : 16 e- => 8 doublets |
| Br2- | 2 Br : 2x7 e- Charge - : + 1 e- Total : 15 e- => 7 doublets + 1 e- célibataire |
| CH2N2 | 8 doublets | 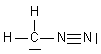 |
| Si2O76- | 28 doublets | 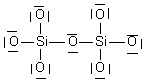 |
| NO2+ | 8 doublets | 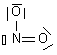 |
| Br2- | 7 doublets + 1 célibataire | 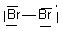 |
| CH2N2 | 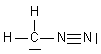 | C : n = 4 ; ici 1 doublet et 3 liaisons soit 2+3 = 5 => - N1 : n= 5 ; ici 4 liaisons soit 4 => + N2 : n= 5 ; ici 1 doublet et 3 liaisons soit 2 + 3 = 5 => neutre | 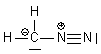 | |
| Si2O76- |  | Si : n=4 ; ici 4 liaisons soit 4 => neutre O1 : n=6 ; ici 3 doublets et 1 liaison soit 3x2 +1 = 7 => - O2 : n=6 ; ici 2 doublets et 2 liaisons soit 2x2+2 = 6 => neutre | 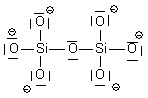 | |
| NO2+ | 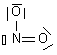 | N : n= 5 ; ici 3 liaisons soit 3 => 2+ O1 : n=6 ; ici 3 doublets et 1 liaison soit 3x2 +1 = 7 => - O2 : n=6 ; ici 2 doublets et 2 liaisons soit 2x2+2 = 6 => neutre | 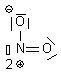 | |
| Br2- | 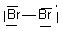 | Br1 : n=7 ; ici 3 doublets et 1 liaisons soit 6 + 1 = 7 => neutre Br2 : n=7 ; ici 3 doublets et 1 liaisons et 1 e- soit 6 + 1 + 1 = 8 => - | 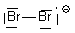 |
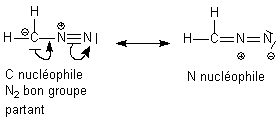 a
priori ces deux formes sont acceptables. La seconde devrait être
privilégiée car elle porte la charge - sur l'atome le plus
électronégatif
a
priori ces deux formes sont acceptables. La seconde devrait être
privilégiée car elle porte la charge - sur l'atome le plus
électronégatif 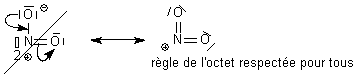 La première forme est interdite
car elle ne respecte pas la règle de l'octet pour N . Seule la deuxième
forme est acceptable dans un exercice qui vous demande de donner la
structure de Lewis de NO2.
La première forme est interdite
car elle ne respecte pas la règle de l'octet pour N . Seule la deuxième
forme est acceptable dans un exercice qui vous demande de donner la
structure de Lewis de NO2. 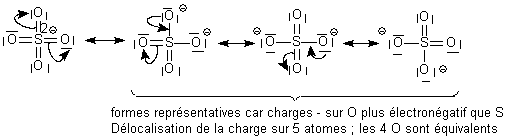 La première forme n'est a priori pas interdite, mais l'atome de
soufre portant la charge négative est peu compatible avec les
électronégativités relatives de S et de O ( O>S) . Elle ne sera donc
pas écrite . On rappelle que le soufre peut déroger à la règle de
l'octet sans problème.
La première forme n'est a priori pas interdite, mais l'atome de
soufre portant la charge négative est peu compatible avec les
électronégativités relatives de S et de O ( O>S) . Elle ne sera donc
pas écrite . On rappelle que le soufre peut déroger à la règle de
l'octet sans problème.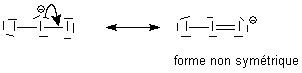 La
première forme sera largement privilégiée . L'argument de non symétrie
est valable : on constate expérimentalement que la géométrie de I3- est exclusivement imposée par cette écriture.
La
première forme sera largement privilégiée . L'argument de non symétrie
est valable : on constate expérimentalement que la géométrie de I3- est exclusivement imposée par cette écriture.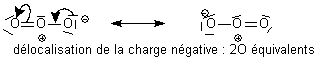 Les deux écritures équivalentes seront obligatoirement données toutes les deux pour montrer l'équivalence des deux O terminaux.
Les deux écritures équivalentes seront obligatoirement données toutes les deux pour montrer l'équivalence des deux O terminaux. La
première forme est la seule obligatoire, dans la mesure où les deux
autres mentionnent des charges, et un C qui ne respecte pas la règle de
l'octet. Toutefois , on est amené à les écrire pour montrer
l'électrophilie de ces deux carbones.
La
première forme est la seule obligatoire, dans la mesure où les deux
autres mentionnent des charges, et un C qui ne respecte pas la règle de
l'octet. Toutefois , on est amené à les écrire pour montrer
l'électrophilie de ces deux carbones. 